— простые белки — Биохимия
Структура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в «чистом» виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые и при выделении in vitro они оказываются свободным от других молекул — простым белком.
Альбумины
Альбумины – это группа схожих белков плазмы крови с молекулярной массой 69 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот.
В природе альбумины входят в состав не только плазмы крови (сывороточные альбумины), но и яичного белка (овальбумин), молока (лактальбумин), являются запасными белками семян высших растений.
Глобулины
Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в «осадочных» пробах (тимоловая, Вельтмана). Несмотря на то, что их относят к простым, часто содержат углеводные компоненты.
При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины.
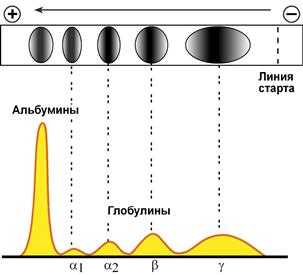
Картина электрофореграммы (вверху) белков сыворотки крови
и полученной на ее основе протеинограммы (внизу)
Так как глобулины включают в себя разнообразные белки, то их функции разнообразны:
Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови и межклеточного матрикса от преждевременного разрушения, например, α1-антитрипсин, α1-антихимотрипсин, α2-макроглобулин.
Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносит ионы железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина), гемопексин (транспорт гема).
γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.
Гистоны
Взаимодействие гистонов и ДНК |
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются с дезоксирибо-нуклеиновой кислотой (ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, h3b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%).
Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Можно выделить две функции гистонов:
1. Регуляция активности генома, а именно – они препятствуют транскрипции.
2. Структурная – стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, h3b, НЗ, Н4. Гистон h2 связан с молекулой ДНК, не позволяя ей «соскользнуть» с гистонового октамера. ДНК обвивает нуклеосому 2,5 раза после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз.
Далее такие «бусы» нуклеосом могут складываться в суперспираль и в более сложную структуру нуклеопротеина.
Благодаря гистонам и формированию более сложных структур размеры ДНК, в конечном итоге, уменьшаются в тысячи раз: на самом деле
Протамины
Это белки массой от 4 кДа до 12 кДа, имеются в ядрах сперматозоидов многих организмов, в сперме рыб они составляют основную массу белка. Протамины являются заменителями гистонов и служат для организации хроматина в спермиях. По сравнению с гистонами протамины отличаются резко увеличенным содержанием аргинина (до 80%). Также, в отличие от гистонов, протамины обладают только структурной функцией, регулирующей функции у них нет, хроматин в сперматозоидах неактивен.
Коллаген
Коллаген – фибриллярный белок с уникальной структурой, составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
Полипептидная цепь коллагена включает 1000 аминокислот и носит название α-цепь. Насчитывается около 30 вариантов α-цепи коллагена, но все они обладают одним общим признаком – в большей или меньшей степени включают повторяющийся триплет [Гли-Х-Y], где X и Y – любые, кроме глицина, аминокислоты. В положении X чаще находится пролин или, гораздо реже, 3-оксипролин, в положении Y встречается пролин и 4-оксипролин. Также в положении Y
Жесткая циклическая структура пролина и оксипролина не позволяет образовать правозакрученную α-спираль, но образует т.н. «пролиновый излом». Благодаря такому излому формируется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка.
При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Также коллаген обычно содержит моносахаридные (галактоза) и дисахаридные (глюкоза-галактоза) молекулы, связанные с ОН-группами некоторых остатков оксилизина.
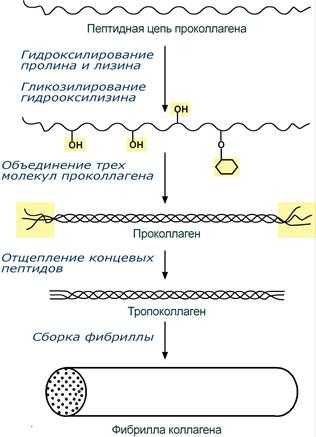
Этапы синтеза молекулы коллагена
Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.
Фибриллы коллагена очень прочны, они прочнее стальной проволоки равного сечения. В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген.
Гидроксилирование пролина осуществляет железо-содержащий фермент пролилгидроксилаза для которого необходим витамин С (аскорбиновая кислота). Аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствии аскорбиновой кислоты, оказывается недостаточно гидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов, и проявляется как
Гидроксилирование лизина осуществляет фермент лизилгидроксилаза. Она чувствительна к влиянию гомогентизиновой кислоты (метаболит тирозина), при накоплении которой (заболевания алкаптонурия) нарушается синтез коллагена, и развиваются артрозы.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между глицином и лейцином.
По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Это ведет к повышенной ломкости кости и снижению прозрачности роговицы глаза в старческом возрасте.
В результате распада коллагена образуется гидроксипролин. При поражении соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидроксипролина возрастает и имеет диагностическое значение.
Эластин
Строение десмозина |
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обусловливает наличие спиральных эластичных участков.
Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4-мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях.
α-Аминогруппы и α-карбоксильные группы десмозина включаются в пептидные связи одной или нескольких белковых цепей.
Роль десмозина в соединении белков
biokhimija.ru
Витамины для кожи. Как грамотно увеличить синтез коллагена?
А давайте еще раз про синтез коллагена и как его грамотно усилить с помощью добавок! А все успели закупиться на iHerb? Я под скидки заказала 4 большие посылки, и легко собрала бы еще парочку! Столько новых хотелок появилось и все нужно! Это все подруга-осень )))
 Недавно я написала про коллаген, который сейчас пью и мы разобрались, как работает генератор коллагена Биосил, начинать который лучше в зрелом возрасте! Хотя как мы, 35 и 40-летние девочки можем причислить себя к зрелому возрасту? )) Никак! ))
Недавно я написала про коллаген, который сейчас пью и мы разобрались, как работает генератор коллагена Биосил, начинать который лучше в зрелом возрасте! Хотя как мы, 35 и 40-летние девочки можем причислить себя к зрелому возрасту? )) Никак! ))
Поэтому продолжаем пить наши добавки и узнаем, как грамотно усилить синтез коллагена в коже.
Для этого к добавкам коллагена и Биосила просто необходимо добавить вещества, которые также участвуют в синтезе коллагена. Без них коллаген не сможет стать прочным, останется слабым и молодым.
Вы когда-нибудь задумывались над таким поворотом событий? ))
Важно! Основные добавки, которые участвуют в сложном процессе образования коллагена: аминокислоты, витамин С, магний, сера, медь, цинк, проантоцианиды.
Нужные нам аминокислоты уже есть в наших коллагеновых добавках или ″усиленном варианте″ Proglyme.
Аминокислоты являются кирпичиками для образования самого первого коллагена — проколлагена. И только потом, при участии витамина С, образуется тройная спиральная структура коллагена.
Важно! Самыми главными аминокислотами для синтеза коллагена являются пролин и глицин. Они обязательно должны быть в комплексе аминокислот для кожи!
Для наглядности покажу схему синтеза коллагена, в котором участвует три аминокислоты. Третья аминокислота гидроксипролин также есть в наших добавках коллагена, или преобразуется путем изменения пролина:

Пролин составляет почти 15% всего коллагена! Она участвует в очень важном начальном этапе образования коллагеновых волокон. Без пролина они просто не смогут образоваться! Также, пролин препятствует накоплению жира в артериях, что равноценно здоровому сердцу.
Глицин тоже составляет основную часть коллагена. Это самая маленькая по размеру аминокислота, но одна из главных! А еще глицин одна из трех аминокислот, которые образуют креатин. Она повышает энергию во время тренировок в зале.

Магний самый необходимый минерал для синтеза коллагена и эластина в коже!
Известный факт, что дефицит магния в организме сильно замедляет процесс образования нового коллагена. А дефицит есть у большинства населения, поэтому я обеими руками за обязательный ежедневный прием магния и просто обожаю этот минерал. И всем советую! )))
В мультивитаминах его ничтожное количество, а магний влияет на здоровую сердечно-сосудистую систему и балансирует нервную. Поэтому, чтобы самочувствие было спокойным, а коллаген усиленно вырабатывался как в молодости, вы должны ежедневно пить магний.
⇒ Я советую хелат магния Chelated Magnesium моя лучшая добавка, или же глицинат магния, который только-только заказала. Он уже с аминокислотой глицином ))

Сера повышает синтез коллагена и формирует правильный коллаген!
Она усиливает прочность дисульфидных связей, которые скрепляют коллагеновые волокна и создают прочный, упругий коллаген. Уникальная форма органической серы MSM в натуральном виде содержится во фруктах и овощах, она растворима в воде и поэтому, наш организм усваивает ее наиболее эффективно!
Также сера обладает противовоспалительным действием (хорошо при акне), работает как антиоксидант и считается признанным ″витамином красоты″ для кожи и волос. Дозировка около 1000 мг в день идеальна, ее можно пить в моно-препарате. Но, гораздо выгоднее в комплексе!
Я советую Солгар витамины Кожа, волосы, ногти содержат серу MSM, или гиалуроновую кислоту с MSM для увлажнения кожи.

Флавоноиды это растительные пигменты, они более мощные, чем традиционные антиоксиданты: витамины С и Е, бета-каротин. При постоянном употреблении, флавоноиды дают мощный эффект защиты коллагеновых структур от повреждения.
Особенно полезны для коллагеновых структур синие и фиолетовые пигменты антоцианидины и проантоцианидин олигомеры, найденные в кожице винограда и черники, а также в экстрактах сосновой коры и виноградной косточки.
Они влияют на метаболизм коллагена во многих отношениях:
- Сшивают коллагеновые волокна, что усиливает соединительную ткань
- Предотвращают повреждения свободными радикалами, благодаря мощным антиоксидантному действию
- Предотвращают высвобождение соединений, вызывающих воспаление
- Защищают коллагеновые структуры от ферментов, которые выделяют белых кровяных клеток во время воспаления
Для обеспечения необходимого уровня флавоноидов, нам нужно увеличить потребление ярко окрашенных ягод! А также, дополнить питание добавками проантоцианидин олигомеров, таких как экстракт виноградных косточек или коры сосны.
Эффективная дозировка на каждый день 50-150 мг в сутки.

Могу посоветовать три экстракта, богатых проантоцианидинами:
- Конечно Solgar, Grape Seed Extract, дозировка 1 капсула в день
- Natural Factors Grape Seed Extract, дозировка 1 капсула в день
- Ресвератрол плюс Country Life, Resveratrol Plus, дозировка 1 капсула в день
Расскажите, какие витамины для кожи вы УЖЕ принимаете, чтобы мне знать, в каком двигаться направлении? Чувствуете эффект или какие-то изменения с кожей? Давайте делиться личным опытом!
Читайте также:
simply4joy.ru
синтез, усвоение, как восполнить дефицит
Фибриллярные белки и коллаген.
Что такое фибриллярные белки? Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру.
Нитевидная структура — хорошо. Почему? Да из нитей легко создать или сшить гибкие, подвижные, эластичные, прочные ткани, как кожа, ногти, связки, сухожилия и т.д. Как одежда, отличается по свойствам друг от друга в первую очередь составом ткани, так и ткани человеческого тела, отличаются составом фибриллярных белков.
К фибриллярным белкам относят:
- коллаген, эластин, кератин, выполняющие в организме человека структурную функцию;
- миозин, участвующий в мышечном сокращении;
- фибрин — белок свёртывающей системы крови.
Сегодня говорим о коллагене, т.к. он превалирует. В коже его порядка 70%.
Итак, коллаген
Коллаген содержится практически везде. Не только в суставах и коже.
Кожа. Она состоит из волокон коллагена и эластина и основной ткани – матрицы. Коллаген составляет около 75 % сухой массы, а эластин – около 4 %. Эластин растягивается очень сильно (до 200–300 %), примерно как резина. Коллаген может растягиваться до 10 %, что соответствует капроновому волокну.
Мышцы. В состав мышц входит соединительная ткань, состоящая из волокон коллагена и эластина. Поэтому механические свойства мышц подобны механическим свойствам полимеров.
Механическое поведение скелетной мышцы следующее: при быстром растяжении мышц на определенную величину напряжение резко возрастает, а затем уменьшается. При большей деформации происходит увеличение межатомных расстояний в молекулах.
Ткань кровеносных сосудов (сосудистая ткань). Механические свойства кровеносных сосудов определяются главным образом свойствами коллагена, эластина и гладких мышечных волокон.
Это основа для других тканей и органов: оболочек, кожи, хрящей, костей, связок мышц, сосудов и даже нервной системы.
Коллаген считается самым распространённым видом белка у млекопитающих, составляющий от 25% до 35% белков во всём теле. Коллагены есть везде.
Дефицит коллагена!
Понятно, что большая часть коллагена находиться в суставах.
Факторов разрушения коллагена много:
- cо стороны хрящевой ткани — дегенерация межпозвонковых дисков (остеохондроз), хруст, грыжи, скрежет, ухудшение состояния суставных хрящей (артрозы), проблемы с бронхами (бронхит, бронхоэктазы). Однако нужно заметить, что коллаген больше отвечает не за хруст, а за боли. За состояние самих суставов. А синовиальная жидкость, т.к. смазка суставов — это несколько другой вопрос;
- со стороны кожи — ранние и глубокие морщины;
- со стороны сосудистой стенки ее истончение и, как следствие повышение угрозы разрывов сосудов, аневризм и увеличения количества атеросклеротических бляшек, которые появляются в ответ на нарушение целостности сосудистой стенки;
- со стороны кишечника — запоры и проблемы с пищеварением;
- со стороны хрусталика — ухудшение зрения.
Но что мы можем сделать при нарушении его синтеза, при метаболическом дефиците?
Усвоение коллагена
Знаете ли вы, как переваривается белок?
Как известно, белок состоит из кирпичиков-аминокислот, которые соединены между собой пептидной связью.
Очень известная аналогия, и очень удачная. Аналогия с кирпичиками. Любой белок, который мы съедим, будет разрушен до кирпичиков (аминокислот). И только потом наше тело, используя кирпичики, будет строить свой собственный уникальный белок.
Деградация белка катализируется протеиназами: в желудке — пепсинами, а в тонком кишечнике — трипсином, химотрипсином и эластазой. Образующиеся при этом пептиды далее гидролизуются различными пептидазами до аминокислот.
Любой продукт белковой природы, что мы съедим, всегда будет разрушен до аминокислот. И всосется в тонком кишечнике только в виде аминокислот. Иногда в виде 2ух или 3ех связанных между собой аминокислот. Т.е. ди и трипептидов. Пептиды всасываются в виде ди- и трипептидов путем пассивного переноса или активного транспорта с участием переносчиков.
Телу все равно, что вы съели, будь то коллаген или курица. Организм обязан стереть чужеродную генетическую информацию и превратить белок в строительный аминокислотный материал. А если по какой-либо причине белок, что мы съели, не будет нормально переварен и попадет в кровоток, то последствия будут в виде аллергии и пр., т.к. тело будет распознавать непереваренный белок как чужеродный.
Любой белок, принимаемый перорально, будет разрушен до составных элементов. Не стоит тешить надежду на то, что коллаген из пищи как-либо встроится в наш собственный.
Любую белковую пищу нужно рассматривать ТОЛЬКО с точки зрения аминокислотного состава. И, только. Только аминокислоты и их пропорции могут на нас влиять.
Аминокислотный состав коллагена
Коллаген скуден по аминокислотному составу, и считается неполноценным белком, как и продукт переработки коллагена — желатин, о котором поговорим чуть ниже.
Коллаген имеет необычный аминокислотный состав: 1/3, или 33% всего коллагена составляет глицин.
Глицин- это заменимая аминокислота, значит, организм может ее вырабатывать сам без всяких проблем.
Пролина там тоже очень много. Это тоже, заменимая аминокислота.
Необходимо сказать, что есть модификации этих аминокислот, такие как гидроксипролин и гидроксилизин.
В составе коллагена есть еще аланин. И он тоже является заменимой аминокислотой.
Так же есть аргинин, условно незаменимая алифатическая аминокислота. Все остальные незаменимые аминокислоты, % которых хоть как-то можно назвать весомым в коллагене — это аминокислота лизин.
Самое главное в коллагене конечно же это лизин, т.к. это единственная из всех незаменимая. Значит, коллаген можно рассматривать как источник лизина, что хорошо.
Но, увы, даже в самом очищенном коллагене сух, лизина даже меньше, чем в обычном сывороточном протеине.
Поэтому, рассматривать коллаген как источник незаменимых аминокислот для своих суставов нельзя!
В коллагене много заменимых аминокислот. Их реально там много.
Берем не качеством, а количеством:
- Потенциальная польза в коллагене заключается именно в заменимых аминокислотах и в их ГИПЕРДОЗАХ, ибо в коллагене того же самого глицина аж 33 г на 100 г.
- Еще в коллагене есть особые 2 аминокислоты: гидроксипролин и гидроксилизин (модифицированные).
Производители коллагена уверяют, что именно эти 2 редкие аминокислоты оказывают незаменимую пользу нашей соединительной ткани. Так ли это?
Как происходит синтез коллагена?
Поскольку коллаген не существует без гидроксипролина и гидроксилизина, поедая эти аминокислоты, мы облегчаем жизнь своему коллагену.
ОН будет строиться быстрее, т.к. не нужно эти аминокислоты создавать. Это производные пролина, о котором мы говорили и лизина, о котором мы тоже упомянули.
ЗВУЧИТ РЕАЛЬНО КРУТО, да? Я, сперва, сам так подумал. Однако это НЕПРАВДА. К большому сожалению. Они никак не помогут нам при построении своего собственного коллагена. Почему? Очень просто.
Во-первых, cначала строятся нити без всяких там гидроксиаминокислот. Т.е. у нас в цепи нормальный пролин. И, только потом уже на готовой цепи подвешивают гидроксигруппу к пролину.
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов.
Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты.
Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится ЖЕЛЕЗО.
Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается полноценным ВИТАМИНОМ С.
Полноценность Витамину С придают БИОФЛАВОНОИДЫ: гесперидин, рутин, кверцетин, кемпферол и др. Это не только аскорбиновая кислота!
Дефицит Витамина С нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги.
Внеклеточный этап — модификация молекул проколлагена.
В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена).
Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками) — необходим кислород, сера и специфический фермент лизилоксидаза…
Внеклеточное «дозревание» коллагена. «Сшивание» коллагеновых фибрил — необходимы Сера, кислород и
Фермент лизилоксидаза.
Особенностью этого фермента является присутствие Cu2+ в активном центре. Без меди невозможно дозревания коллагена.
Для синтеза коллагена необходимы Кальций, Магний, Фосфор, Железо, Медь, Витамин Д3 (Остео плюс), аминокислоты (в том числе незаменимые, для эффективной работы ферментов), антиоксиданты, достаточное количество АТФ, полноценный Витамин С, Сера, Фосфолипиды, кислород, Омега-3 кислоты.
Не слабо, правда!
Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы только теряют эти белки и кожа стареет.
Без СЕРЫ нет пространственной конфигурации белков. Нет жизни, нет способа существования белковых тел.
Любой белок, независимо от того, какую функцию он несёт, это не просто цепочка, состоящая из аминокислот. Так же, как у каждого из нас есть своё определённое лицо, каждый белок — это определённая структура. Один белок имеет одну структуру, другой — другую.
Эта структура прочная, потому что она объединена, прежде всего, ковалентными химическими связями (осуществляются парой электронов, общих для двух атомов). И обязательно образуются такие S-S-мостики (СЕРА).Когда варим, пережариваем белок, то эти S-S-связи рвутся, происходит так называемая денатурация, порча белков.
Когда образуются S-S-связи, тогда и только тогда появляется пространственная конфигурация. Эластин и коллаген — невероятно зависят от наличия органической серы.
Т.е. организм не использует вот эти хваленые гидрокси аминокислоты, что мы могли получить из сьеденного колагена. ОН ВСЕ ПРОДУЦИРУЕТ ВНОВЬ! САМ!
Во вторых, не существует РНК, которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь.
Делали исследование. Кормили крыс радиоактивным гидроксипролином и гидроксилизином. Смотрели, будет ли коллаген из этих радиокативных аминокислот состоять. Конечно же НЕТ!
Это еще в 1954 году провели эксперемент. А продавцы коллагена до сих пор настаивают, что помогает. Было бы весело, если не было бы грустно.
Если мы едим гидроксиаминокислоты, то все они будут все равно приведены до состояния нормальных аминокислот и только потом будут использоваться.
И никак иначе.
Синтез коллагена очень зависим от слаженной работы гормонов щитовидной железы и отсутствия инсулинорезистентности!
Вывод: коллаген по аминокислотам ценен только пролином, глицином, аланином, аргинином — т.е., заменимыми аминокислотами, которых в коллагене действительно много.
Как лечебный препарат для восстановления суставов, связок, омоложения кожи — малоэффективен.
Как дополнительный источник заменимых аминокислот — имеет место быть.
У спортсменов. Людей без дефицита полноценных белков в еде, в принципе нет потребности в коллагене, как суплементе.
Гораздо интереснее и правильнее восполнять дефицит нутриентов, о которых мы говорили. Обеспечить здоровое всасывание их в кишечнике — ежегодная реабилитация ЖКТ. Создать условия для синтеза собственного коллагена и гликоаминогликанов (о них ещё поговорим).
Что такое желатин и что такое гидролизованный коллаген?
Желатин — это коллаген, который был подвержен разрушению. Усваивается легче, чем просто сырой материал.
Гидролизованный коллаген.
Это желатин, который еще несколько раз обработали. Он еще больше разрушился и еще легче переваривается и расщепляется до аминокислот. В этом вся разница, в обработке.
Желатин — средняя степень обработки.
Гидролизованный коллаген — высокая степень обработки.
Переваривание и всасывание зависит от обработки коллагена, т.е. от его биодоступности.
Желатин и гормон роста. (Бонус 🙂 для спортсменов)
Исследование:
Лучшим источником аргинина из всех белков является желатин и соя. Выяснилось, что потребление желатина в пищу существенно повышает секрецию гормона роста после приема. Выше, чем все другие белки. Соя на 2 месте. Считается, что это все благодаря аргинину. Но,через 2 часа! после употребления. Дозировка. Вес 80кг — 48гр. желатина.
Из лекции врача-нутрициолога Аркадия Бибикова.
www.rabotamamam.com
СИНТЕЗ КОЛЛАГЕНА
Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных.
1-Й ЭТАП
Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген.
2-Й ЭТАП
С помощью сигнального пептида “пре” транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется “пре” — образуется “проколлаген”.
3- Й ЭТАП
Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы..
При недостатке витамина “С” — аскорбиновой кислоты наблюдается цинга, — заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления.
4-Й ЭТАП
Посттрасляционная модификация — гликозилирование проколлагена под действием фермента гликозилтрансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина.
5-Й ЭТАП
Заключительный внутриклеточный этап — идет формирование тройной спирали — тропоколлагена (растворимый коллаген). В составе про-последовательности — аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации.
6-Й ЭТАП
Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность.
7-Й ЭТАП
Ковалентное “сшивание” молекулы тропоколлагена по принципу “конец-в-конец” с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь.
Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена).
8-Й ЭТАП
Ассоциация молекул нерастворимого коллагена по принципу “бок-в-бок”. Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи.
Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном.
Рисунок 3
Катаболизм коллагена
Нативный коллаген не гидролизуется обычными пептидгидролазами, основной фермент катаболизма коллагена — коллагеназа. Коллаген — медленно обменивающийся белок, о скорости его обмена судят по содержанию оксипролина в крови и моче. Катаболизм коллагена более активен в молодом возрасте (до 20 лет) и при некоторых заболеваниях (коллагенозы, гиперпаратиреоидизм, некоторые инфекционные заболевания).
Эластические волокна
2-й вид волокон — эластические. В основе строения — белок эластин. Эластин еще более гидрофобен, чем коллаген. В нем до 90% гидрофобных аминокислот.
Эластин — это основной структурный компонент эластических волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. Эластин — гликопротеин с молекулярной массой 70 кД, который содержит много гидрофобных аминокислот (Гли, Вал, Ала, Лей, Про). В отличие от большинства белков пептидные цепи эластина не приобретают характерную третичную структуру, а сохраняют гибкую случайную конформацию (рис.5).
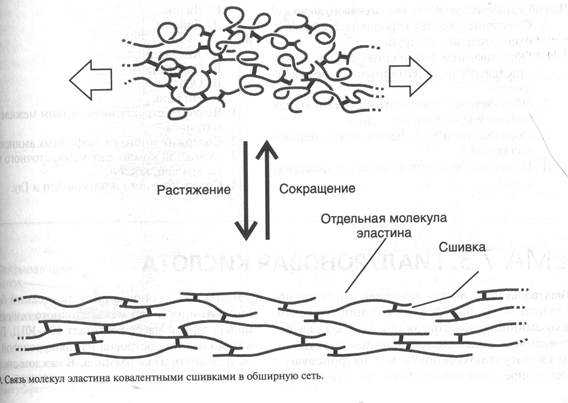
Рисунок 5
В межклеточном матриксе молекулы эластина образуют волокна, сети, слои, в которых отдельные молекулы связаны множеством сшивок.
Наличие гибкой случайной конформации молекул эластина и большого количества поперечных сшивок позволяет эластическим волокнам проявлять свои резиновоподобные свойства.
Клеточные элементы соединительной ткани
Это фиброблсты, тучные клетки, макрофаги. В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50% за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
biohimist.ru
Регуляция синтеза коллагена
Синтез коллагена стимулируют половые гормоны, инсулин, СТГ, тиреоидные гормоны, аскорбиновая кислота (а также синтез протеогликанов и пролиферацию фибробластов).
Синтез коллагена тормозят глюкокортикоиды (путём снижения уровня мРНК проколлагена и ингибированием активности пролил-и лизилгидроксилазы), сам коллаген и N-пpoпептиды после своего отщепления.
Патологии образования коллагена
При дефиците витамина С нарушается гидроксилирование пролина и лизина, и образуются менее прочные коллагеновые волокна. В результате развивается цинга, при которой наблюдаются: повышенная хрупкость и ломкость кровеносных сосудов, множественные точечные кровоизлияний под кожу и слизистые оболочки, кровоточивость дёсен, выпадение зубов, анемия.
При снижении активности проколлагенпептидаз (синдром Элерса-Данло-Русакова, тип VII) концевые пропептиды проколлагена не отщепляются, нарушается образование тропоколлагена и образование нормальных коллагеновых волокон. Клинически это проявляется малым ростом, искривлением позвоночника, привычными вывихами суставов, высокой растяжимостью кожи.
При снижении активности лизилоксидазы, при недостатке меди, витаминов РР, В6нарушается образование поперечных сшивок и, снижается прочность и упругость коллагеновых волокон. Такие структуры, как кожа, сухожилия, кровеносные сосуды, становятся хрупкими, легко разрываются.
Также существует ряд наследственных заболеваний, связанных с нарушением структуры или синтеза коллагена. Основная причина — мутации в генах коллагена, которые широко представлены в разных хромосомах.
При многих заболеваниях наблюдают не только костно-суставную патологию или изменения со стороны кожи, но и ярко выраженные висцеральные проявления: поражения кишечника, почек, лёгких, сердца, сосудов.
Катаболизм коллагена
Разрушение коллагеновых волокон осуществляется активными формами кислорода и ферментативно (гидролитически) коллагеназами тканевыми и бактериальными.
Тканевая коллагеназасодержитZn2+, имеет 4 изоформы, синтезируется фибробластами и макрофагами соединительной ткани.
Тканевая коллагеназа разрезает тройную спираль коллагена на расстоянии около ¼ от С-конца, между глицином и лейцином (изолейцином). Образующиеся фрагменты водорастворимы, они спонтанно распадаются на отдельные цепи, которые гидролизуются различными протеазами до АК.
Тканевую коллагеназу активируют плазмин, калликреин и катепсин В. Чувствительность коллагена к действию коллагеназы и неспецифических протеаз повышает недостаточное гидроксилирование остатков пролина и лизина.
Нарушение распада коллагена ведет к фиброзу органов и тканей (в основном печени и легких).
Диагностика скорости распада коллагена
В результате распада коллагена в крови и моче появляется свободный гидроксипролин. Большая часть этой аминокислоты катаболизируется под действием фермента гидроксипролиноксидазы, а часть её выводится с мочой, и поэтому гидроксипролин является маркерной аминокислотой, по которой судят о скорости распада коллагена.
При некоторых заболеваниях, связанных с поражением соединительной ткани, экскреция гидроксипролина увеличивается вследствие ускоренного распада коллагена. Это наблюдается при болезни Педжета, гиперпаратиреозе, коллагенозах, некоторых инфекционных заболеваниях. При нарушении катаболизма гидроксипролина, причиной которого обычно выступает дефект фермента гидроксипролиноксидазы, выделение гидроксипролина может превышать 1 г/сут.
studfiles.net
В каких продуктах содержится коллаген и как увеличить его синтез
Коллагеном называют особый белок, придающий форму, прочность и эластичность соединительной ткани, которой представлены человеческая кожа, мышцы, связки, сухожилия, хрящи, кости. Достаточный синтез коллагена сохраняет человеку здоровые, молодые, подвижные суставы и связки.
Читайте более подробно о том, что такое коллаген и зачем он нужен.
Важность коллагена для связок и суставов
При любых физических нагрузках именно на коллагеновые нити приходится особо сильное воздействие. Только прочные нити коллагена, находящиеся в ткани в достаточном количестве, способны:
- укрепить костную, хрящевую, мышечную ткани;
- предотвратить разрыв тканей и уберечь от травм;
- обеспечить эластичность сухожилий, связок, мышц.
Особое внимание коллагену следует уделить:
- атлетам;
- людям, испытывающим дискомфорт или боль в суставах при нагрузках;
- травмированным спортсменам;
- пожилым людям, т. к. с возрастом синтез коллагена замедляется.
Синтез коллагена в организме
Коллаген не может поступить в организм с продуктами питания в том виде, в котором он существует в человеческом теле. Как любой другой вид белка, коллаген синтезируется в организме из остатков аминокислот, поступивших с пищей богатой белком. Условно молекулу коллагена можно представить как соединение остатков трех аминокислот: глицина, пролина или лизина и остатка нестандартной аминокислоты, состав которой отличается для разных органов человеческого тела. Молекулы коллагена кожи, связок, костей, мышц разные из-за разных третьих аминокислот, входящих в их состав.
Глицин замедляет истончение хрящевой и мышечной ткани, регенерирует поврежденные участки любой соединительной тканей человеческого организма.
Лизин является незаменимой аминокислотой, содержащейся во многих белковых продуктах. Он:
- участвует в формировании костной ткани организма;
- отвечает за усвоение кальция и азота;
- важен для синтеза не только коллагена, но и антител, гормонов, ферментов.
Это самая важная аминокислота для быстрого восстановления поврежденных в результате травм или операций тканей.
Недостаток этой аминокислоты в организме приводит к:
- снижению прочности коллагеновых нитей;
- усталости;
- нарушению пищеварения и потере аппетита;
- снижению массы тела.
Пролин входит в состав обеспечивает прочность коллагеновых нитей кожи, хрящевых сумок, сердца.
Поступление оставшихся 25 известных человечеству аминокислот также важно для синтеза коллагена. Однако почти все из них содержатся в тех же продуктах, что и важнейшие коллагеновые кислоты.
Качественный синтез коллагена обеспечивают кремний, медь, цинк, железо, сера.
Интересное видео о продукте, который поможет поддержать синтез белка на должном уровне:
Для синтеза коллагена и обеспечения нормальной работы его волокон необходимо поступление в организм некоторых витаминов в количестве не ниже суточной нормы.
Продукты содержащие коллаген
Минимальное поступление с пищей минералов витаминов, без которых невозможен синтез коллагена
| Витамины и минералы | Минимальная суточная потребность организма в витамине или минерале |
| Витамин С | минимум 150 мг |
| Витамин А | более 700 мкг |
| Витамин D | 5-10 мкг (200-400 МЕ) |
| Витамин Е | не менее 10 мг |
| Цинк | женщинам не менее 9 мг, мужчинам – 11 |
| Медь | 1,5 мг |
| Железо | мужчинам 15 мг, женщинам не менее 20 мг |
| Сера | около 1 г |
Продукты, содержащие аминокислоты, которые необходимы для выработки коллагена
| Продукты | Глицинг на 100 г продукта | Лизинг на 100 г продукта |
| Говядина | 1,19 | 1,66 |
| Индейка | 1,31 | 1,97 |
| Курятина | 1,13 | 1,39 |
| Баранина | 0,8 | 1,44 |
| Сёмга | 0,95 | 0,82 |
| Горбуша | 1,26 | 1,76 |
| Коровье молоко | 0,07 | 0,26 |
| Козье молоко | 0,46 | 0,23 |
| Творог | 0,26 | 1,01 |
| Твердые сыры | 0,4-0,5 | 1,95-2 |
| Креветки | 1,03 | 1,64 |
| Горох | 0,95 | 1,55 |
| Фасоль | 0,91 | 1,6 |
| Арахис | 1,52 | 0,49 |
| Фундук | 0,72 | 0,42 |
| Миндаль | 1,47 | 0,58 |
Пролин является заменимой кислотой, т. е. синтезируется в организме из многих белковых продуктов. Рекордсменом можно назвать молоко и молочные продукты – 80 -87% белков этих продуктов представлены специальным белком казеином, являющимся основой для построения пролина организмом.
Продукты, содержащие витамин С
| Продукты | Витамин Св мг на 100 г продукта |
| Шиповник | 1000 |
| Болгарский перец | 300 |
| Черная смородина | 220-250 |
| Киви | 180 |
| Капуста, зелень | 100-110 |
| Калина | 70 |
| Цитрусовые | 60 |
Продукты, содержащие витамин D
| Продукты | Витамин DМЕ на 100 г продукта |
| Макрель | 350 |
| Сельдь | 300 |
| Лосось | 200 |
| Сливочное масло | 150 |
| Печень животных ,птиц | 100 |
| Желтки куриных яиц | 50 |
Продукты, содержащие витамин А
| Продукты | Витамин Ав мг на 100 г продукта |
| Рыбий жир | 19 |
| Говяжья печень | 8,2 |
| Куриный желток | 1,26 |
| Икра | 1,0 |
| Творог | 0,1 |
Продукты, содержащие витамин Е
| Продукты | Витамин Ев мг на 100 г продукта |
| Соевое масло | 114 |
| Соя | 17,3 |
| Фасоль | 3,8 |
| Овсяная крупа | 3,4 |
| Макароны | 2,10 |
Продукты, содержащие цинк
| Продукты | Цинкв мг на 100 г продукта |
| Устрицы | 60 |
| Говяжья печень | 16 |
| Угри | 12 |
| Куриные сердца | 7,3 |
| орехи | 4-6 |
Продукты, содержащие медь
| Продукты | Медьв мг на 100 г продукта |
| Печень рыб | 10-12,5 |
| Шпинат | 7 |
| Какао | 4,3 |
| Шиповник | 1,8 |
| Орехи | 1,14-1,8 |
Продукты, содержащие железо
| Продукты | Железов мг на 100 г продукта |
| Печень животных | 10-20 |
| Какао | 12-14 |
| Гречка | 8 |
| Бобовые | 6 |
| Мясо птицы | 3-5 |
Продукты, содержащие серу
| Продукты | Серав мг на 100 г продукта |
| Говядина | 230 |
| Рыба | 200-210 |
| Курица, куриные яйца | 180 |
| Молоко | 28 |
| Сыры твердые | 25 |
Также нужно включить в рацион шпинат, зелень, чернику, зеленый чай, богатые специальными веществами, укрепляющими коллагеновые волокна.
Поскольку список продуктов, необходимых для нормального синтеза коллагена достаточно внушительный, многие предпочитают употреблять промышленные добавки, содержащие коллаген, витамины и минералы. Некоторые употребляют обычный пищевой желатин, 1 столовая ложка которого содержит необходимый для синтеза коллагена список аминокислот. Правда, нужно будет побеспокоиться о достаточном поступлении минералов и витаминов.
Правильно подобранный рацион и дополнительные добавки помогут сохранить нормальный синтез коллагена в организме, обеспечив здоровье суставам и связкам. Будьте внимательны к себе!
athleticbody.ru
Регуляция синтеза коллагена
Синтез коллагена стимулируют половые гормоны, инсулин, СТГ, тиреоидные гормоны, аскорбиновая кислота (а также синтез протеогликанов и пролиферацию фибробластов).
Синтез коллагена тормозят глюкокортикоиды (путём снижения уровня мРНК проколлагена и ингибированием активности пролил-и лизилгидроксилазы), сам коллаген и N-пpoпептиды после своего отщепления.
Патологии образования коллагена
При дефиците витамина С нарушается гидроксилирование пролина и лизина, и образуются менее прочные коллагеновые волокна. В результате развивается цинга, при которой наблюдаются: повышенная хрупкость и ломкость кровеносных сосудов, множественные точечные кровоизлияний под кожу и слизистые оболочки, кровоточивость дёсен, выпадение зубов, анемия.
При снижении активности проколлагенпептидаз (синдром Элерса-Данло-Русакова, тип VII) концевые пропептиды проколлагена не отщепляются, нарушается образование тропоколлагена и образование нормальных коллагеновых волокон. Клинически это проявляется малым ростом, искривлением позвоночника, привычными вывихами суставов, высокой растяжимостью кожи.
При снижении активности лизилоксидазы, при недостатке меди, витаминов РР, В6нарушается образование поперечных сшивок и, снижается прочность и упругость коллагеновых волокон. Такие структуры, как кожа, сухожилия, кровеносные сосуды, становятся хрупкими, легко разрываются.
Также существует ряд наследственных заболеваний, связанных с нарушением структуры или синтеза коллагена. Основная причина — мутации в генах коллагена, которые широко представлены в разных хромосомах.
При многих заболеваниях наблюдают не только костно-суставную патологию или изменения со стороны кожи, но и ярко выраженные висцеральные проявления: поражения кишечника, почек, лёгких, сердца, сосудов.
Катаболизм коллагена
Разрушение коллагеновых волокон осуществляется активными формами кислорода и ферментативно (гидролитически) коллагеназами тканевыми и бактериальными.
Тканевая коллагеназасодержитZn2+, имеет 4 изоформы, синтезируется фибробластами и макрофагами соединительной ткани.
Тканевая коллагеназа разрезает тройную спираль коллагена на расстоянии около ¼ от С-конца, между глицином и лейцином (изолейцином). Образующиеся фрагменты водорастворимы, они спонтанно распадаются на отдельные цепи, которые гидролизуются различными протеазами до АК.
Тканевую коллагеназу активируют плазмин, калликреин и катепсин В. Чувствительность коллагена к действию коллагеназы и неспецифических протеаз повышает недостаточное гидроксилирование остатков пролина и лизина.
Нарушение распада коллагена ведет к фиброзу органов и тканей (в основном печени и легких).
Диагностика скорости распада коллагена
В результате распада коллагена в крови и моче появляется свободный гидроксипролин. Большая часть этой аминокислоты катаболизируется под действием фермента гидроксипролиноксидазы, а часть её выводится с мочой, и поэтому гидроксипролин является маркерной аминокислотой, по которой судят о скорости распада коллагена.
При некоторых заболеваниях, связанных с поражением соединительной ткани, экскреция гидроксипролина увеличивается вследствие ускоренного распада коллагена. Это наблюдается при болезни Педжета, гиперпаратиреозе, коллагенозах, некоторых инфекционных заболеваниях. При нарушении катаболизма гидроксипролина, причиной которого обычно выступает дефект фермента гидроксипролиноксидазы, выделение гидроксипролина может превышать 1 г/сут.
studfiles.net
