Инкапсуляция — это… Что такое Инкапсуляция?
Инкапсуляция — (лат. in в, capsula коробочка ; итал. incapsulare закупоривать) 1. Изоляция, закрытие чего либо мешающего, ненужного, вредного с целью исключения отрицательного влияния на окружающее. (Поместить радиоактивные отходы в капсулу, закрыть… … Википедия
ИНКАПСУЛЯЦИЯ — (лат.). Изменение одних слов в другие, в американских языках. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. инкапсуляция (лат. in в) образование капсулы 1 вокруг чуждых для организма веществ (инородных тел,… … Словарь иностранных слов русского языка
Инкапсуляция — в объектно ориентированном программировании сокрытие внутренней структуры данных и реализации методов объекта от остальной программы. Другим объектам доступен только интерфейс объекта, через который осуществляется все взаимодействие с ним. По… … Финансовый словарь
инкапсуляция — инкапсулирование Словарь русских синонимов.
инкапсуляция «IP в IP» — Для инкапсуляции в дейтаграмму IP используется инкапсуляция IP в IP (IP in IP), для этого перед существующим заголовком IP дейтаграммы вставляется внешний заголовок IP (МСЭ Т Y.1281). [http://www.iks media.ru/glossary/index.html?glossid=2400324]… … Справочник технического переводчика
ИНКАПСУЛЯЦИЯ — (от лат capsula ящик, капсула, сумка), осумкование, термин, употребляющийся для обозначения разрастания соединительнотканной капсулы, сумки вокруг тех или иных пат. образований, паразитов и пр. тел, не подвергающихся почему либо рассасыванию в… … Большая медицинская энциклопедия
инкапсуляция — скрытие включение вбирание Термин объектно ориентированного программирования, означающий структурирование программы на модули особого вида, называемые классами и объединяющие данные и процедуры их обработки, причем внутренние данные класса не… … Справочник технического переводчика
инкапсуляция — (incapsulatio; ин + лат. capsula ящичек, оболочка) процесс отграничения очага воспаления или инородного тела путем образования вокруг него фиброзной оболочки (капсулы) … Большой медицинский словарь
capsula ящичек, оболочка) процесс отграничения очага воспаления или инородного тела путем образования вокруг него фиброзной оболочки (капсулы) … Большой медицинский словарь
инкапсуляция — инкапсуляция, инкапсуляции, инкапсуляции, инкапсуляций, инкапсуляции, инкапсуляциям, инкапсуляцию, инкапсуляции, инкапсуляцией, инкапсуляциею, инкапсуляциями, инкапсуляции, инкапсуляциях (Источник: «Полная акцентуированная парадигма по А. А.… … Формы слов
инкапсуляция — инкапсул яция, и … Русский орфографический словарь
ИНКАПСУЛЯЦИЯ — (от лат. in в, внутри и capsula коробочка, ящичек), разрастание соединительной ткани вокруг инородных тел или мёртвых масс, образующихся в органах и тканях при различных патологических процессах … Ветеринарный энциклопедический словарь
| Да, а как же совершенная инкапсуляция жизни в Пауни? | |
Инкапсуляция-это захват главных моментов в истории. | |
| Инкапсуляция является отличительной чертой комиксов и существенным соображением при создании произведения комиксов. | |
| Инкапсуляция информации означает, что обработка информации в модуле не может быть затронута информацией в остальной части мозга. | |
| Инкапсуляция обеспечивается тем, что логика управления ресурсами определяется один раз в классе, а не на каждом узле вызова. | |
| Инкапсуляция также может быть прозрачной или тонированной для улучшения контраста и угла обзора. | |
| Эта инкапсуляция определена в спецификации IEEE 802.3 ac и увеличивает максимальный кадр на 4 октета. | |
| Инкапсуляция также возможна в не объектно-ориентированных языках. | |
| Инкапсуляция является характерной чертой большинства сетевых моделей, включая как модель OSI, так и набор протоколов TCP/IP. | |
Это определение было расширено и включает в себя большинство продуктов питания, где инкапсуляция ароматизаторов является наиболее распространенной. | |
| Термин инкапсуляция часто используется как синоним сокрытия информации. | |
| Таким образом, инкапсуляция является основным принципом хорошей архитектуры программного обеспечения, на каждом уровне детализации. | |
| Основываясь на принципах наслоения протоколов в OSI, инкапсуляция протокола, а не конкретно GRE, нарушает порядок наслоения. | |
| Многопротокольная инкапсуляция через ATM определена в RFC 2684. | |
| Универсальная инкапсуляция потока, или сокращенно GSE, — это протокол уровня канала передачи данных, определенный DVB. | |
| Инкапсуляция состояния необходима для того, чтобы иметь возможность принудительно применять инварианты класса. | |
| Основное различие между этими двумя парадигмами заключалось в том, что инкапсуляция считалась главным требованием. | |
Для объектно-ориентированной парадигмы инкапсуляция была одним из, если не самым важным, критических требований. | |
| Свободная связь в вычислениях интерпретируется как инкапсуляция по сравнению с неинкапсуляцией. | |
| Как правило, после распыления инкапсуляция каждой капли завершается примерно за 0,1 секунды с самого начала процесса. | |
| Одним из распространенных методов подготовки является инкапсуляция. | |
| Инкапсуляция и переопределение-это две основные отличительные особенности между вызовами методов и процедур. | |
| Инкапсуляция также позволяет избежать времени высыхания ковровых шампуней, что делает ковер сразу же доступным для использования. | |
| Один из них-это инкапсуляция знаний о том, какие конкретные классы использует система. | |
| Объектные базы данных также вводят ключевые идеи объектного программирования, такие как инкапсуляция и полиморфизм, в мир баз данных. | |
| Инкапсуляция данных привела к важной концепции ООП сокрытия данных. | |
Инкапсуляция не позволяет внешнему коду быть связанным с внутренней работой объекта. | |
| Инкапсуляция-это метод, который поощряет развязывание. | |
| Другие результаты | |
| Книга Харта, помимо того, что она является полезной инкапсуляцией мировой истории, является бесконечным источником пьянящих дебатов. | |
| Внутренний заголовок TTL уменьшается перед инкапсуляцией и не изменяется в декапсуляторе. | |
Организация, инкапсуляция, метаплазия
2
Организация
и инкапсуляция
– компенсаторные процессы, развивающиеся
в патологических условиях при наличии
в повреждённых органах очагов некроза
и тромбоза, экссудата (гной, фибрин),
продуктов патологического синтеза
(амилоида, других аномальных белков),
выпавших из коллоидного раствора солей
(фосфат и карбонат кальция, ураты,
оксалаты, глюкуронаты и др.), а также при
внедрении в организм паразитов и
инородных тел.
Организация
– замещение дефекта ткани, очага, некроза
или тромба вновь образованной
соединительной тканью. Организации
предшествует острый серозный воспалительный
процесс вокруг очага омертвения или
инородного тела, лейкоцитарная или
макрофагальная (в том числе гигантоклеточная)
реакции. При этом происходят размягчение,
ферментативное (гидролитическое)
расплавление и рассасывание мёртвого
субстрата. По мере его рассасывания в
дефект врастает грануляционная ткань
с большим количеством вновь образованных
капилляров и клеток гематогенного и
соединительнотканного происхождения.
После завершения резорбции дефект
полностью замещается волокнистой
соединительной тканью, а при её созревании
и рубцовой тканью. Неполная регенерация
с исходом в организацию и рубцевание
наблюдается при заживлении ран, прямых
и послевоспалительных некрозов и
инфарктов, тромбов и инфекционных
гранулём.
Инкапсуляция, или осумкование, — образование соединительнотканной оболочки вокруг мёртвой массы, инородных тел. Этот процесс наблюдается в тех случаях, когда уплотнённый мёртвый субстрат не рассасывается, а обрастает соединительной тканью, отделяющей его от здоровой части органа капсулой. Вновь образованная соединительная ткань, особенно её внутренний слой, может подвергаться гиалинозу, а иногда оссификации. В мёртвой ткани выпадают соли кальция с развитием обызвествления. Разновидность инкапсуляции – секвестрация, которая развивается при частичном расплавлении мёртвого субстрата по периферии очага с отслоением его от секвестральной капсулы. В некоторых случаях при недостаточной регенерации соединительной ткани происходит инцистирование, возникает инкапсулированная полость, или киста, с жидким содержимым.
Перестройка
тканей
в организме возникает при изменениях
условий их существования и деятельности,
характера питания и кровообращения,
иннервации. При затруднении кровотока
в каком-либо крупном сосуде под влиянием
физических, химических или биологических
воздействий наблюдается
компенсаторно-приспособительная
перестройка ангиоархитектоники органа
за счёт включения коллатерального
кровообращения. Изменение питания, силы
и направленности физической нагрузки
на костную ткань сопровождается
перестройкой системы костных трабекул
губчатого вещества и костных пластин
(остеонов компактной кости). При рахите,
остеодистрофии, переломе костей,
патологии суставов существенно
перестраивается костная система, а в
процессе заживления костной ткани и
выздоровления её наблюдаются регенерация
и гиперплазия.
При затруднении кровотока
в каком-либо крупном сосуде под влиянием
физических, химических или биологических
воздействий наблюдается
компенсаторно-приспособительная
перестройка ангиоархитектоники органа
за счёт включения коллатерального
кровообращения. Изменение питания, силы
и направленности физической нагрузки
на костную ткань сопровождается
перестройкой системы костных трабекул
губчатого вещества и костных пластин
(остеонов компактной кости). При рахите,
остеодистрофии, переломе костей,
патологии суставов существенно
перестраивается костная система, а в
процессе заживления костной ткани и
выздоровления её наблюдаются регенерация
и гиперплазия.
Метаплазия
–
переход недифференцированных молодых
клеток из одного вида в другой родственный
вид. Переход клеток в другой вид возможен
только в пределах одного зародышевого
листка путём размножения клеток, поэтому
этот процесс определяется как непрямая,
или новообразовательная метаплазия.
По происхождению и биологической
сущности метаплазия представляет собой
одну из форм физиологической, репаративной
или патологической регенерации, при
которой новая ткань отличается от
предшествующей по своим морфологическим
признакам и функциональным свойствам. Непосредственно превращение клеток в
другой вид не происходит.
Непосредственно превращение клеток в
другой вид не происходит.
Различают прозопластическую и анапластическую метаплазию.
Прозопластическая метаплазия – перестройка клеток с образованием новой ткани с более высоким уровнем дифференциации и специализации по сравнению с исходной тканью. Так, например, возникают гладкомышечные клетки из камбиальных предшественников миофибробластов с образованием из капилляров крупных сосудов типа артерий и вен со средним слоем гладкомышечных клеток. Такая метаплазия наблюдается в коллатеральных сосудах лёгкого и других органах при различного рода поражениях их. Путём метаплазии развиваются гиперплазия железистого эпителия из эпителия выводных протоков желёз, гиперплазия костной и хрящевой тканей из соединительной, неороговевающего плоского эпителия в цилиндрический в желудке и кишечнике и т.д.
Анапластическая
метаплазия
– перестройка клеток с образованием
новой ткани с менее высоким уровнем
дифференциации и специализации по
сравнению с исходной тканью. Например,
переход призматического эпителия
дыхательных путей, пищеварительного
тракта, придатка семенника, матки в
ороговевающий плоский (эпидермальная
метаплазия) при гиповитаминозе А и
других хронических болезнях.
Например,
переход призматического эпителия
дыхательных путей, пищеварительного
тракта, придатка семенника, матки в
ороговевающий плоский (эпидермальная
метаплазия) при гиповитаминозе А и
других хронических болезнях.
Гистологической аккомодацией, или адаптацией, называют морфологическую перестройку тканей в изменившихся условиях их функционирования (ложная метаплазия). Например, призматический или кубический эпителий в щитовидной железе при коллоидной дистрофии принимает уплощённую форму. В участках ателектаза лёгких в связи с непоступлением воздуха плоский альвеолярный эпителий преобразуется в кубический и т.д. При этом изменение внешней формы клеток происходит без специфических структурных и функциональных отклонений от нормы.
Дисплазия и гетероплазия относятся к врождённым тканевым аномалиям или к местным нарушениям в развитии органов (образование костной ткани среди мышечной, островков поджелудочной железы в желудке).
Смещение
тканей,
или гетеротопия
встречающаяся при травмах или врождённых
пороках, к метаплазии не относится.
Инкапсуляция клапана Ahmed как основная причина неудач Текст научной статьи по специальности «Клиническая медицина»
инкапсуляция клапана ahmed как основная причина неудач его имплантации
© О. Г. Павлова, В. П. Николаенко, Л. М. Константинова
СПб ГБУЗ «Городская многопрофильная больница № 2», Санкт-Петербург
G Цель работы: изучить взаимосвязь послеоперационной гипертензивной фазы с инкапсуляцией пластинки клапана Ahmed. Методы: стандартная методика имплантации клапана Ahmed выполнена 238 пациентам в возрасте 18—86 лет с многократно оперированной первичной глаукомой (39 %), вторичной неоваскулярной (36 %), артифакической (23 %), ювенильной (8 %), увеальной (5 %) и посттравматической (2 %) глаукомами. Рутинный офтальмологический осмотр пациентов осуществлялся спустя 1 неделю, 1, 3, 6, 9, 12 и 36 месяцев после операции. Результаты: иссечение фиброзной капсулы, как единственный способ борьбы с офтальмогипер-тензией, было выполнено 16 пациентам спустя 3—36 месяцев после операции. Произведён макро-и микроскопический анализ иссечённых капсул. Во всех случаях получены препараты толщиной 1,2 — 2,2 мм. Следует отметить двухслойность капсулы, внутренняя поверхность выполнена плотно упакованными коллагеновыми волокнами, в то время как наружный слой представлен рыхлым фиброваскулярным слоем. Приостановление инкапсуляции возможно на начальных этапах рубцевания с помощью массажа глазного яблока, нидлинга, ревизии зоны операции, инъекции антиметаболитов.
Результаты: иссечение фиброзной капсулы, как единственный способ борьбы с офтальмогипер-тензией, было выполнено 16 пациентам спустя 3—36 месяцев после операции. Произведён макро-и микроскопический анализ иссечённых капсул. Во всех случаях получены препараты толщиной 1,2 — 2,2 мм. Следует отметить двухслойность капсулы, внутренняя поверхность выполнена плотно упакованными коллагеновыми волокнами, в то время как наружный слой представлен рыхлым фиброваскулярным слоем. Приостановление инкапсуляции возможно на начальных этапах рубцевания с помощью массажа глазного яблока, нидлинга, ревизии зоны операции, инъекции антиметаболитов.
G Ключевые слова: рефрактерная глаукома; инкапсулированная фильтрационная подушка; дренажная система Ahmed.
УДК 617.7-007.681 ГРНТИ 76.29.56 ВАК 14.01.07
актуальность
Основные требования, предъявляемые к современным гипотензивным операциям — стабилизация зрительных функций путём стойкой нормализации внутриглазного давления при минимальном числе осложнений.
Ведущей задачей гипотензивной хирургии является формирование длительно функционирующих путей оттока, снижение внутриглазного давления, что позволяет снизить прогрессирование глаукомной нейрооптикопатии.
Особую сложность представляет решение этой задачи у пациентов с рефрактерной глаукомой, отличающейся упорным течением, зачастую на фоне болевого синдрома, играющей ведущую роль в инва-лидизации офтальмологических больных.
Под термином «рефрактерная глаукома» в офтальмологии принято подразумевать заболевания, при которых невозможно достичь компенсации внутриглазного давления ни медикаментозными средствами, ни традиционными хирургическими методами. Отличительной способностью рефрактерных глауком является выраженная фибропластическая активность тканей глаза, приводящая к грубому рубцеванию и облитерации сформированных в ходе операций путей оттока внутриглазной жидкости [1].
Для борьбы с рефрактерной глаукомой применяются консервативные, традиционные хирургические (синустрабекулэктомия) и лазерные циклодеструк-тивные виды лечения, однако они не всегда способны обеспечить нормализацию офтальмотонуса, и, как следствие, стабилизацию зрительных функций.
Одной из основных причин неудач дренажной хирургии является избыточное рубцевание тканей в зоне произведённого вмешательства, приводящее к облитерации созданных путей оттока внутриглазной жидкости [2].
Ряд факторов, таких как наличие рубцово — изменённой конъюнктивы в зоне планируемой операции, многолетнее использование гипотензивных средств с консервантами, недостаточное кровоснабжение тканей глазного яблока при глаукоме, приводящее к тканевой гипоксии, выраженная послеоперационная воспалительная реакция и молодой возраст приводят к выраженному фиброзированию послеоперационной раны.
Так как инкапсуляция клапана, являющаяся типовой биологической реакцией на инородное тело, имплантированное в организм, в некоторых случаях приобретает чрезмерную выраженность и сопровождается стойким подъёмом внутриглазного давления, то изучение тканевых реакций, сопровождающих длительное пребывание клапана в тканях глаза, представляет большой интерес.
цель
Изучить взаимосвязь послеоперационной гипер-тензивной фазы с процессом инкапсуляции клапана Ahmed.
материалы и методы
Типичная имплантация клапана Ahmed выполнена 238 пациентам в возрасте 18—86 лет. Из многочисленных разновидностей рефрактерной глаукомы преобладали ранее неоднократно оперированная первичная глаукома (94 пациента, 39 %), а также вторичные неоваскулярная (87 человек, 36 %) и артифакическая (55 пациентов, 23 %) глаукомы. Другие формы рефрактерной глаукомы, такие как ювенильная (21 человек, 8 %), увеальная (12 человек, 5 %), вторичная посттравматическая глаукома (7 человек, 2 %) составили не более 15 % группы исследуемых пациентов. У 106 человек (44,5 %) глаукома достигла терминальной стадии. У 30 пациентов операция выполнялась на единственном зрячем глазу.
Другие формы рефрактерной глаукомы, такие как ювенильная (21 человек, 8 %), увеальная (12 человек, 5 %), вторичная посттравматическая глаукома (7 человек, 2 %) составили не более 15 % группы исследуемых пациентов. У 106 человек (44,5 %) глаукома достигла терминальной стадии. У 30 пациентов операция выполнялась на единственном зрячем глазу.
Все пациенты в момент поступления в стационар использовали максимальный режим закапывания гипотензивных капель (два и более препарата различных фармакологических групп). При выборе квадранта учитывалось состояние склеры и конъюнктивы, наличие рубцово изменённой ткани в зоне предшествующих оперативных вмешательств.
Из 238 прооперированных пациентов 32 посещали контрольные осмотры менее 6 месяцев, и, соответственно, вошли в группу «недостаточного динамического наблюдения». Под контролем остались 206 человек.
Осмотр пациентов осуществлялся спустя 1 неделю, 1, 3, 6, 9, 12, 24 и 36 месяцев после оперативного вмешательства. Стандартный объём исследования в каждой контрольной точке включал в себя визометрию, периметрию (HUMPHREY 750i Field Analyzer), тонометрию (тонометр Маклакова), биомикроскопию (щелевая лампа TOMEY TSL-5000), В-сканирование (при необходимости) NIDEK US-4000, офтальмоскопию и биомикроскопию с асферическими линзами. При осмотре и оценке фильтрационной подушки обращали внимание на ее элевацию, напряжённость, гладкость поверхности, толщину стенки, васкуляризацию и форму купола.
Стандартный объём исследования в каждой контрольной точке включал в себя визометрию, периметрию (HUMPHREY 750i Field Analyzer), тонометрию (тонометр Маклакова), биомикроскопию (щелевая лампа TOMEY TSL-5000), В-сканирование (при необходимости) NIDEK US-4000, офтальмоскопию и биомикроскопию с асферическими линзами. При осмотре и оценке фильтрационной подушки обращали внимание на ее элевацию, напряжённость, гладкость поверхности, толщину стенки, васкуляризацию и форму купола.
У 16 пациентов в возрасте 29—77 лет в связи с упорной офтальмогипертензией, не купируемой максимальной терапией, выполнено иссечение фиброзной стенки в различные сроки после имплантации: спустя два месяца после операции (два пациента), шесть месяцев — (три человека), спустя
год — (пять человек), через два года — (три пациента), через три года — (три человека).
Из них четыре пациента страдали неоваскулярной, один — увеальной, девять человек составили группу с ранее неоднократно оперированной первичной глаукомой. Двум пациентам, страдающим первичной ювенильной глаукомой, потребовалось повторное иссечение капсулы с выполнением 5—7 субконъюн-ктивальных инъекций 5-фторурацила.
Двум пациентам, страдающим первичной ювенильной глаукомой, потребовалось повторное иссечение капсулы с выполнением 5—7 субконъюн-ктивальных инъекций 5-фторурацила.
Полученные ткани подверглись макро- и микроскопическому анализу. Материал фиксировался в 10 % растворе нейтрального формалина. Выполнено обезвоживание в спиртах восходящей концентрации, получены залитые в парафин блоки, изготовленные срезы толщиной 4—5 мкм окрашивали гематоксилином и эозином.
результаты
У 21 человека гипертензивная фаза была купирована путём выполнения нидлинга (нидлинг — ревизия фильтрационной подушки иглой 27—30 G, с целью формирования новых путей оттока внутриглазной жидкости). Нормализации ВГД удалось достичь в 9 случаях. 12 пациентов отказались от последующей операции (иссечение капсулы) в силу различных причин.
Данным пациентам гипотензивная терапия была усилена. Был достигнут стойкий эффект. ВГД составило 14 — 20 мм рт. ст.
Был достигнут стойкий эффект. ВГД составило 14 — 20 мм рт. ст.
Выраженная инкапсуляция пластины клапана, вызывающая длительный, стойкий подъем внутриглазного давления, требующая повторного хирургического вмешательства, была отмечена в 16 случаях (7,7 %) спустя 3—36 месяцев после операции.
По данным гистопатологического исследования выявлена двухслойность капсулы. В среднем, стенка капсулы имела толщину 1,2—2,2 мм.
Гладкая внутренняя поверхность представляла собой плотно упакованные коллагеновые волокна [13]. Наружная (внешняя) поверхность представлена рыхлым фиброваскулярным слоем.
Следует отметить, что спустя 1,5—2 месяца после операции происходило уплотнение капсулы, в результате изменения соотношения клеток (фи-бробластов) и волокнистых структур. Это можно расценить, как преобразование рыхлой соединительной ткани в зрелую соединительнотканную капсУлУ [11].
Наличие новообразованных сосудов, содержащих в своем просвете единичные эритроциты, объясняется незрелостью грануляционной ткани, заполняющей практически всю толщу капсулы.
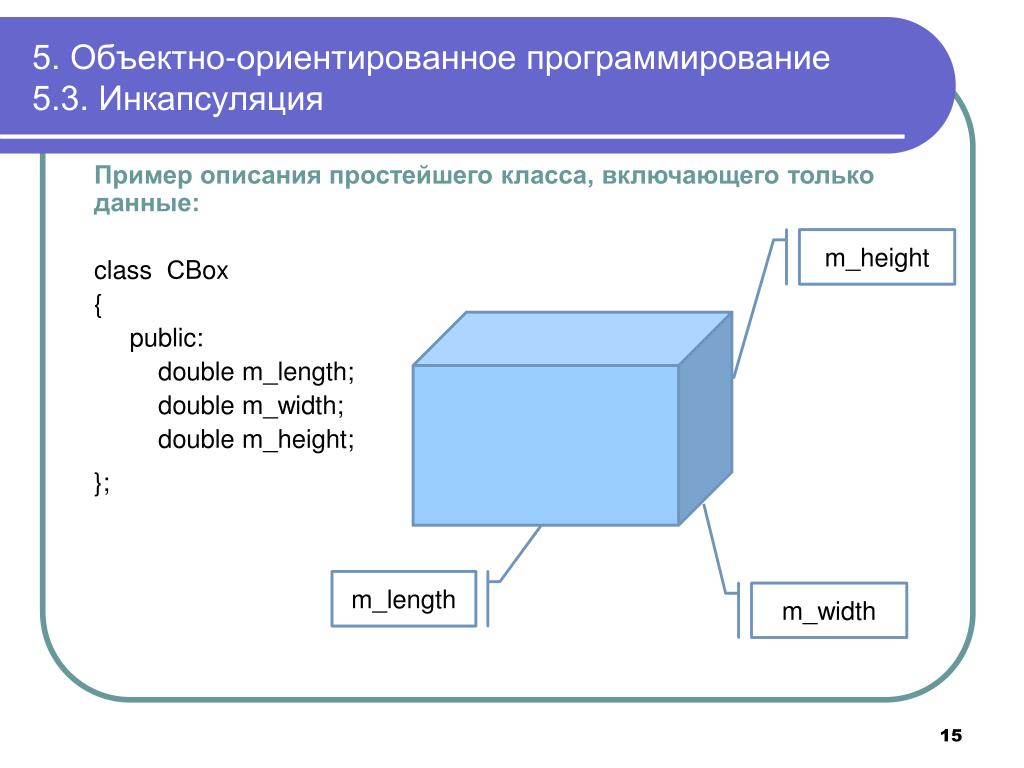
В препарате, полученном спустя 6—7 месяцев, грануляционная ткань была зрелой — в просвете
Рис. 1. Созревающая грануляционная ткань со зрелыми ново- Рис. 2. 7 мес. после имплантации. В зрелой соединительной тка-образованными сосудами, содержащими эритроциты. ни новообразованные сосуды и новообразованные ади-
Окраска гематоксилином и эозином. Ув. х 100 поциты. Окраска гематоксилином и эозином. Ув. х 100
новообразованных сосудов обнаруживались многочисленные эритроциты (рис. 1).
Между капиллярами отмечено разрастание фиброцитов с выраженным межклеточным матриксом, содержащим коллаген. Также отмечается гиалиноз этой ткани. В одном препарате наблюдалась диффе-ренцировка фибробластов в адипоциты, что можно расценить как проявление перестройки соединительной ткани, практически не испытывающей механической нагрузки [1] (рис. 2).
Также отмечается гиалиноз этой ткани. В одном препарате наблюдалась диффе-ренцировка фибробластов в адипоциты, что можно расценить как проявление перестройки соединительной ткани, практически не испытывающей механической нагрузки [1] (рис. 2).
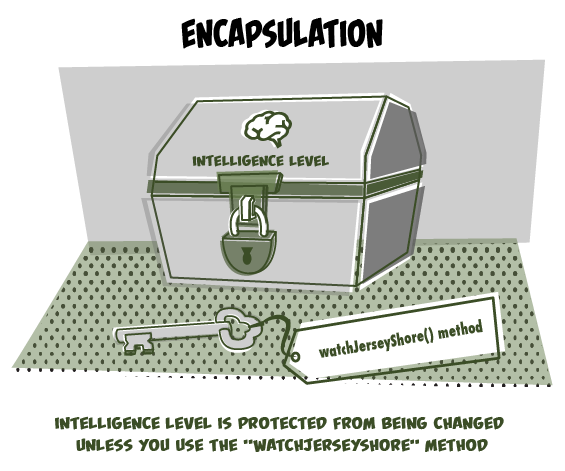
В препарате, полученном спустя год после имплантации клапана, отмечен воспалительный инфильтрат, значительную долю которого составили плазматические клетки с эксцентрично смещённым ядром, косвенно свидетельствующие о наличии в этой зоне инфекции (рис. 3). В данном случае, помимо инкапсуляции, присутствовало обнажение трубки клапана.
Рис. 3. Один год после имплантации. Более зрелая (справа) и менее зрелая с новообразованными сосудами (слева) соединительная ткань. Окраска гематоксилином и эозином. Ув. х 63
обсуждение
Несмотря на совершенствование хирургической техники, формирование кистозных подушек остается основной проблемой хирургии глаукомы и влечет за собой дополнительные вмешательства. По выводам К. Вае е1 а1. (2012), инкапсуляция клапанов составляет от 2,5 до 29 % при различных видах глаукомы. Оценивая данные зарубежных коллег, можно сделать вывод о том, что гипертензивная фаза наблюдается в среднем у 70—80 % пациентов, и напрямую связана с фиброзированием [10].
По выводам К. Вае е1 а1. (2012), инкапсуляция клапанов составляет от 2,5 до 29 % при различных видах глаукомы. Оценивая данные зарубежных коллег, можно сделать вывод о том, что гипертензивная фаза наблюдается в среднем у 70—80 % пациентов, и напрямую связана с фиброзированием [10].
В процессе избыточного рубцевания нельзя не отметить роль TGF-b, относящихся к классу полипептидов, являющимися основными факторами образования экстраклеточного матрикса. Своим высоким содержанием TGF-b в водянистой влаге способствует избыточному синтезу экстраклеточного матрикса астроцитами ДЗН, блокируя отток внутриглазной жидкости [4, 7].
Формирование инкапсулированной подушки отмечается спустя 6 недель после оперативного вмешательства. Физиологическая инкапсуляция пластины клапана несколько отличается от патологического рубцевания и развивается в несколько этапов.
Первоначально вокруг пластины появляется отек, явления воспаления в течение 7 дней после операции, затем отек идет на спад и начинает формироваться фиброзная капсула. Этот процесс формирования соединительнотканной стенки в среднем продолжается 3 недели. В этом периоде можно наблюдать подъем внутриглазного давления длительностью от четырех до шести недель.
Этот процесс формирования соединительнотканной стенки в среднем продолжается 3 недели. В этом периоде можно наблюдать подъем внутриглазного давления длительностью от четырех до шести недель.
Эти ожидаемые физиологические процессы иногда называют гипертензивной фазой послеоперационного периода [8].
Похожие изменения наблюдаются в послеоперационном периоде после выполнения синус-трабекулэктомии [12]. Спустя 2—4 недели после вмешательства в некоторых случаях отмечается подъем внутриглазного давления, связанный с начальными рубцовыми изменениями в зоне операции. Можно отметить различные варианты рубцевания: между конъюнктивой, теноновой оболочкой и эписклерой, в области склерального лоскута, в зоне иссеченной трабекулы [3].
На начальных этапах заживления этот процесс можно попытаться приостановить, используя массаж глазного яблока, нидлинг, ревизию зоны операции. Однако, исходя из накопленного нами опыта, в большинстве случаев, следует признать низкую эффективность данных методов.
Однако, исходя из накопленного нами опыта, в большинстве случаев, следует признать низкую эффективность данных методов.
По данным зарубежных авторов [6], фиброзно изменённая капсула у пациентов с клапаном Ahmed имеет более толстую стенку, чем у пациентов с выполненной синус-трабекулоэктомией, но гистопато-логически они не различаются.
К одним из самых эффективных методов борьбы с избыточной пролиферацией можно отнести использование антиметаболитов, таких как 5-фторурацил. Однако, при использовании антиметаболитов необходимо обеспечивать защиту конъюнктивального лоскута, соблюдать методику хирургической техники аппликации, ибо нарушение этой методики может привести к ряду осложнений, таких как наружная фильтрация в проекции фильтрационной подушки, длительная стойкая гипотония, увеличение размеров подушки, макулопатия и др. Не рекомендуется использование антиметаболитов при выраженном истончении конъюнктивы, а также у пациентов с высокой близорукостью [5].
выводы
При имплантации клапана Ahmed существует вероятность и, в некоторых случаях, неизбежность осложнений, несмотря на соблюдение методики оперативного вмешательства. Нельзя забывать о существовании предрасполагающих факторов, способствующих инкапсуляции, в связи с чем достижение клинического успеха часто замедлено.
Накопленный нами опыт, а также опыт коллег [9] рекомендует использовать массаж глазного яблока, нидлинг, ревизию зоны операции, инъекции антиметаболитов с целью подавления пролиферации и замедления образования рубцовой ткани, что позволит приостановить инкапсуляцию на начальных этапах рубцевания.
При формировании фиброзной капсулы, вызывающей офтальмогипертензию, рекомендовано иссечение изменённой фильтрационной подушки, как наиболее эффективный способ борьбы.
Необходимо информировать пациентов, находящихся под динамическим наблюдением, о возможности проявления «гипертензивной фазы».
список литературы
1. Астахов Ю. С., Николаенко В. П., Дьяков В. Е. Использование политетрафторэтиленовых имплантов в офтальмохирургии. Фолиант, 2007. 69-72 с.
2. Белова Л. В., Балашевич Л. И., Сомов Е. Е. и др. Непосредственные и отдаленные результаты операций непроникающего типа у больных с открытоугольной глаукомой. Глаукома. 2003; 4: 30-34.
3. Гупало О. Д., Слонимский С. Ю., Кулик А. В. Сравнительный анализ отдаленных результатов антиглаукомных операций. Глаукома. 2011; 1: 19-22.
4. Курышева Н. И. Глаукомная оптическая нейропатия. М.: МЕДпресс-информ; 2006: 36.
5. Нестеров А. П. Глаукома. М.: Медицина; 1995: 255.
6. Bae K, Suh W., Kee C. Comparative study of encapsulated blebs following Ahmed glaucoma valve implantation and trabeculectomy with Mytomycin-C. Korean J. Ophthalmol. 2012; 26 (4): 265-270.
7. Choritz L., Wegner M., Forch R. et al. Pathophysiology of fibrotic encapsulation of episcleral glaucoma drainage implants: modification for improvement of clinical results. Ophthalmologe. 2013; 110 (8): 714-721.
8. Feldman R., Bell N. Complications of glaucoma surgery; 2013: 283.
9. Richter C., Shingleton B., Bellows A. et al. The development of encapsulated filtering blebs. Ophthalmology. 1988; 95 (9): 11631168.
10. Rosbach J., Choritz L., Pfeiffer N. et al. Clinical results of encapsulated bleb removal after Ahmed glaucoma valve implants. Ophthalmologe. 2013; 110 (8): 722-727.
Rosbach J., Choritz L., Pfeiffer N. et al. Clinical results of encapsulated bleb removal after Ahmed glaucoma valve implants. Ophthalmologe. 2013; 110 (8): 722-727.
11. Schlotzer-Schrebardt U., Zenkel M., Kuchle M. et al. Role of transforming growth factor-beta1 and its latent form binding protein in pseudoexfoliation syndrome. Exp. Eye Res. 2001; 73 (6): 765-780.
12. Scott D., Quigley H. Medical management of a high bleb phase after trabeculectomies. Ophthalmology. 1988; 95 (9): 1169-1173.
13. Thieme H., ChoritzL., Hofmann-Rummelt C. et al. Histopathologic finding in early encapsulated blebs of young patients treated with the ahmed glaucoma valve. J. Glaucoma. 2011; 20 (4): 246-251.
AHMED VALVE ENCAPSULATION AS A MAIN CAUSE OF ITS IMPLANTATION FAILURES
Pavlova O. G., Nikolayenko V. P., Konstantinova L. M.
G., Nikolayenko V. P., Konstantinova L. M.
Summary. Objective. To study the relationship of post-operative ocular hypertension with the encapsulation of Ahmed valve’s plate. Methods. The standard Ahmed valve implantation was performed in 238 patients aged 18—86 with multiple glaucoma surgeries (39 %), secondary neovascular (36 %), pseudophakic
(23 %), juvenile (8 %), uveal (5 %) and post-traumatic (2 %) glaucomas. A routine ophthalmic examination was performed in 1 week, 1, 3, 6, 9, 12 and 36 months after surgery. Results. Excision of the fibrous capsule as the only way to cope with post Ahmed valve ocular hypertension was performed on 16 patients 3—36 months after surgery. Macro- and microscopic analysis of the excised capsules was done. In all cases, preparations of 1.2—2.2 mm thickness were obtained. We found a bilaminar structure of the capsule, the inner surface consisting of densely-packed collagen fibers, whereas the outer layer is represented by a loose fi-brovascular layer. Suspension of encapsulation is possible at initial stages of scarring, by applying ocular massage, needling, revision of the surgical area, and injection of antimetabolites.
Suspension of encapsulation is possible at initial stages of scarring, by applying ocular massage, needling, revision of the surgical area, and injection of antimetabolites.
G Key words: refractory glaucoma; encapsulated filtering bleb; Ahmed drainage system.
REFERENCES
1. Astakhov Yu. S., Nikolaenko V. P., D’yakov V. E. Ispol’zovanie po-litetraftoretilenovykh implantov v oftal’mokhirurgii. [The use of PTFE implants in ophthalmology] Foliant, 2007. 69-72. (In Russian)
2. Belova L. V., Balashevich L. I., Somov E. E. i dr. Neposredstvennye i otdalennye rezul’taty operatsiy nepronikayushchego tipa u bol’nykh s otkrytougol’noy glaukomoy. [Immediate and remote results of operations non-penetrating type in patients with open-angle glaucoma] Glaukoma. 2003; 4: 30-34. (In Russian)
(In Russian)
3. Gupalo O. D., Slonimskiy S. Yu., Kulik A. V. Sravnitel’nyy analiz otdalennykh rezul’tatov antiglaukomnykh operatsiy. [Comparative
analysis of remote results of antiglaucoma operations] Glaukoma. 2011; 1: 19-22. (In Russian)
4. Kurysheva N. I. Glaukomnaya opticheskaya neyropatiya. [Glaucomatous optic neuropathy] M.: MEDpress-inform; 2006: 36. (In Russian)
5. Nesterov A. P. Glaukoma. [Glaucoma] M.: Meditsina; 1995: 255. (In Russian)
6. Bae K., Suh W., Kee C. Comparative study of encapsulated blebs following Ahmed glaucoma valve implantation and trabeculectomy with Mytomycin-C. Korean J. Ophthalmol. 2012; 26 (4): 265-270.
7. Choritz L., Wegner M., Forch R. et al. Pathophysiology of fibrotic encapsulation of episcleral glaucoma drainage implants: modification for improvement of clinical results. Ophthalmologe. 2013; 110 (8): 714-721.
et al. Pathophysiology of fibrotic encapsulation of episcleral glaucoma drainage implants: modification for improvement of clinical results. Ophthalmologe. 2013; 110 (8): 714-721.
8. Feldman R, Bell N. Complications of glaucoma surgery; 2013: 283.
9. Richter C, Shingleton B, Bellows A. et al. The development of encapsulated filtering blebs. Ophthalmology. 1988; 95 (9): 1163-1168.
10. Rosbach J., ChoritzL, PfeifferN. et al. Clinical results of encapsulated bleb removal after Ahmed glaucoma valve implants. Ophthalmologe. 2013; 110 (8): 722-727.
11. Schlotzer-Schrebardt U, Zenkel M, Kuchle M. et al. Role of transforming growth factor-beta1 and its latent form binding protein in pseudoexfoliation syndrome. Exp. Eye Res. 2001; 73 (6): 765780.
12. Scott D, Quigley H. Medical management of a high bleb phase after trabeculectomies. Ophthalmology. 1988; 95 (9): 1169-1173.
Scott D, Quigley H. Medical management of a high bleb phase after trabeculectomies. Ophthalmology. 1988; 95 (9): 1169-1173.
13. Thieme H., Choritz L, Hofmann-Rummelt C. et al. Histopatho-logic finding in early encapsulated blebs of young patients treated with the ahmed glaucoma valve. J. Glaucoma. 2011; 20 (4): 246-251.
Сведения об авторах:_
Николаенко Вадим Петрович — д. м. н., заместитель главного врача по офтальмологии. Городской офтальмологический центр при ГМПБ № 2. 194354, Санкт-Петербург, Учебный пер., 5. E-mail: [email protected].
Константинова Лариса Михайловна — врач-офтальмолог, заведующая отделением микрохирургии глаза № 1. СПб ГБУЗ «Городская многопрофильная больница №2». 194354, Санкт-Петербург, Учебный пер., 5. E-mail: Dr.KonstantinovaLM@mail. ru.
ru.
Павлова Ольга Геннадьевна — врач-офтальмолог отделения микрохирургии глаза № 1. СПб ГБУЗ «Городская многопрофильная больница №2». 194354, Санкт-Петербург, Учебный пер., 5. E-mail: [email protected].
Nikolayenko Vadim Petrovich — MD, doctor of medical science, head of ophthalmology center. City Ophthalmologic Center of City hospital N 2. 194354, Saint-Petersburg, Uchebny pereulok, 5. E-mail: [email protected].
Konstantinova Larisa Mikhaylovna — head of ophthalmology department N 1. City hospital N 2. 194354, Saint-Petersburg, Uchebny pereulok, 5. E-mail: [email protected].
Pavlova Olga Gennadyevna — ophthalmologist. City Ophthalmologic Center of City hospital N 2. 194354, Saint-Petersburg, Uchebny pereulok, 5. E-mail: [email protected].
Инкапсуляция это в медицине
Инкапсуля́ция (лат. in capsula ; от capsula «коробочка») — размещение в оболочке, изоляция, закрытие чего-либо инородного с целью исключения влияния на окружающее. Например, поместить радиоактивные отходы в капсулу, закрыть кожухом механизм, убрать мешающее в ящик или шкаф.
in capsula ; от capsula «коробочка») — размещение в оболочке, изоляция, закрытие чего-либо инородного с целью исключения влияния на окружающее. Например, поместить радиоактивные отходы в капсулу, закрыть кожухом механизм, убрать мешающее в ящик или шкаф.
- Медицина — образование капсулы вокруг чуждых для организма веществ (инородных тел, паразитов и т. д.), а также технология защиты инородных терапевтических клеток, секретирующих лекарственный препарат, от иммунной системы организма с помощью капсул из полупроницаемой, но иммунозащитной мембраны.
- Информатика, программирование — обеспечение доступности главного, выделение основного содержания путём помещения всего мешающего, второстепенного в некую условную капсулу (чёрный ящик).
- Логика — элемент процесса абстрагирования.
- Приборостроение — нанесение защитных оболочковых покрытий, тонких плёнок (англ. thin films). Широко применяется в процессе создания микроэлектроники и печатных плат.
ИНКАПСУЛЯЦИЯ — (лат. ). Изменение одних слов в другие, в американских языках. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. инкапсуляция (лат. in в) образование капсулы 1 вокруг чуждых для организма веществ (инородных тел,… … Словарь иностранных слов русского языка
). Изменение одних слов в другие, в американских языках. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. инкапсуляция (лат. in в) образование капсулы 1 вокруг чуждых для организма веществ (инородных тел,… … Словарь иностранных слов русского языка
Инкапсуляция — в объектно ориентированном программировании сокрытие внутренней структуры данных и реализации методов объекта от остальной программы. Другим объектам доступен только интерфейс объекта, через который осуществляется все взаимодействие с ним. По… … Финансовый словарь
инкапсуляция — инкапсулирование Словарь русских синонимов. инкапсуляция сущ., кол во синонимов: 1 • инкапсулирование (1) Словарь синонимов ASIS … Словарь синонимов
инкапсуляция «IP в IP» — Для инкапсуляции в дейтаграмму IP используется инкапсуляция IP в IP (IP in IP), для этого перед существующим заголовком IP дейтаграммы вставляется внешний заголовок IP (МСЭ Т Y.1281). [http://www.iks media.ru/glossary/index.html?glossid=2400324]… … Справочник технического переводчика
[http://www.iks media.ru/glossary/index.html?glossid=2400324]… … Справочник технического переводчика
ИНКАПСУЛЯЦИЯ — (от лат capsula ящик, капсула, сумка), осумкование, термин, употребляющийся для обозначения разрастания соединительнотканной капсулы, сумки вокруг тех или иных пат. образований, паразитов и пр. тел, не подвергающихся почему либо рассасыванию в… … Большая медицинская энциклопедия
инкапсуляция — скрытие включение вбирание Термин объектно ориентированного программирования, означающий структурирование программы на модули особого вида, называемые классами и объединяющие данные и процедуры их обработки, причем внутренние данные класса не… … Справочник технического переводчика
инкапсуляция — (incapsulatio; ин + лат. capsula ящичек, оболочка) процесс отграничения очага воспаления или инородного тела путем образования вокруг него фиброзной оболочки (капсулы) … Большой медицинский словарь
инкапсуляция — инкапсуляция, инкапсуляции, инкапсуляции, инкапсуляций, инкапсуляции, инкапсуляциям, инкапсуляцию, инкапсуляции, инкапсуляцией, инкапсуляциею, инкапсуляциями, инкапсуляции, инкапсуляциях (Источник: «Полная акцентуированная парадигма по А. А.… … Формы слов
А.… … Формы слов
инкапсуляция — инкапсул яция, и … Русский орфографический словарь
ИНКАПСУЛЯЦИЯ — (от лат. in в, внутри и capsula коробочка, ящичек), разрастание соединительной ткани вокруг инородных тел или мёртвых масс, образующихся в органах и тканях при различных патологических процессах … Ветеринарный энциклопедический словарь
Существует много понятий инкапсуляции. Инкапсуляция в медицине, информатике логике, даже в окружающем нас мире. Сейчас я хочу рассмотреть инкапсуляцию в медицине и окружающем нас мире.
Понятие в медицине
Инкапсуляция — это процесс ограничения причины воспаления от инородного тела путем образования вокруг нее, так называемой капсулы.
Как образуется защитная капсула:
Рассмотрим самый простой пример из нашей жизни. Человек, который тестирует взрывчатые вещества, ставит опыт над металлической деталью. По неосторожности происходит внезапный взрыв, и металл разлетается во все стороны.
Ему в руку попадают грязные, металлические осколки. Чтобы защитить нашу руку от возможного заражения происходит образование защитной капсулы вокруг металла, тем самым предостерегает от дальнейшего воспаления.
Защита окружающего мира
В этом случае инкапсуляция рассматривается как изоляция чего-то вредного. Допустим, это происходит, когда мы выбрасываем мусор. Все ненужные нам вещи, испорченная еда и прочее. Тем самым происходит изоляция всего вредного от окружающего мира.
Другой, более наглядный пример, поместить опасно химические или радиоактивные отходы в защитную капсулу. Закрыть ее и убрать в недоступное для кого-либо место. Капсула должна быть сделана из материала, который не разлагается, и не разрушается.
Есть поля научной деятельности, где ученые ставят различные опыты. И когда наши ученые изобретут такой материал, они, в прямом смысле этого слова – спасут мир! В таком случае инкапсуляция будет новым шагом в науке и следствием чего будет новый виток в развитии всего человечества. Нам есть над чем работать!
Нам есть над чем работать!
Encapsulated Cell Technology for the Delivery of Biologics to the Mouse Eye
Этот метод инкапсуляции клеток относительно быстр и прост в исполнении; однако, некоторые моменты должны быть в виду, чтобы получить точные результаты вниз по течению. Клетки должны поддерживаться в культуре в чашке Петри до инкапсуляции и проводиться при надлежащей стельности. Инкапсуляция должна выполняться в надлежащем вентиляционном капоте с регулируемым потоком воздуха, если это возможно. Слишком сильный воздушный поток может повлиять на образование капсулы, особенно в длительных экспериментах. Стерильная посуда и растворы имеют решающее значение для долгосрочного поддержания клеток в капсуле.
В настоящее время живое окрашивание используется в качестве подтверждающего инструмента для определения жизнеспособности клеток в капсулах. Количество клеток на капсулу и при нынешнем состоянии (т.е. обычно 12-20 клеток на капсулу) также визуально определяется. С помощью этого метода контролируется жизнеспособность каждой партии инкапсулированных клеточных партий. Для дальнейшего определения жизнеспособности клеток инкапсулированные клетки растворяются и переаплываются. Это еще раз демонстрирует жизнеспособность и целостность клеток в капсулах, подтверждая успешную клеточную инкапсуляцию.
С помощью этого метода контролируется жизнеспособность каждой партии инкапсулированных клеточных партий. Для дальнейшего определения жизнеспособности клеток инкапсулированные клетки растворяются и переаплываются. Это еще раз демонстрирует жизнеспособность и целостность клеток в капсулах, подтверждая успешную клеточную инкапсуляцию.
Параметры, используемые для клеточной инкапсуляции были установлены для данного типа клеток. Приведенные выше параметры используются для инкапсуляции 19 ячеек ARPE для проведения этих экспериментов. Скорость потока, альгинатная концентрация, напряжение и вторичное покрытие капсул — все это переменные, которые могут быть скорректированы для надлежащего использования капсул. Аналогичным образом, количество капсул, необходимых для данного эксперимента, должно быть определено либо эмпирически, либо на основе известного PK/PD биопрепаратов. Важно всегда выполнять соответствующие контрольные эксперименты, добавляя пустые капсулы для контроля за наличием капсул и капсул, загруженных нетрансатифицированными клетками ARPE-19 для контроля на наличие секретных факторов. Клетки ARPE-19 также могут быть задушены контрольной плазмидой, так как наличие даже небольшого количества капсул в небольшом стекловидном телесном состоянии мыши (Злт;10 л), как представляется, изменяет нормальную физиологию глаза. В этом контексте важно знать секретом клеток APRE-19 в условиях инкапсуляции (а также в присутствии стекловидного тела в конкретном состоянии болезни), так как выделяемые белки могут повлиять на эффективность исследуемого биологического.
Клетки ARPE-19 также могут быть задушены контрольной плазмидой, так как наличие даже небольшого количества капсул в небольшом стекловидном телесном состоянии мыши (Злт;10 л), как представляется, изменяет нормальную физиологию глаза. В этом контексте важно знать секретом клеток APRE-19 в условиях инкапсуляции (а также в присутствии стекловидного тела в конкретном состоянии болезни), так как выделяемые белки могут повлиять на эффективность исследуемого биологического.
Наконец, этот метод был внедрен для обеспечения доказательства принципа для долгосрочной доставки комплементоров для лечения AMD и для улучшения текущего метода внутривитровтровых инъекций14. На текущей стадии развития, дополняют ингибиторы вводятся в стекловидное, как правило, с помощью ежемесячных инъекций. Это включает в себя инъекцию фактора дополнения D блокируя антитела lampalizumab18, который не удалось в фазе III клинических испытаний, чтобы уменьшить прогрессирование географической атрофии, или дополнение фактор 3 ингибитор APL-219, который в настоящее время находится в фазе III клинических испытаний.
Интравитальной инъекции препятствуют побочные эффекты самой инъекции (т.е. риск отслоения сытины, повышение внутриглазного давления, эндофталмит и т.д.). Кроме того, уровни наркотиков будут значительно варьироваться в течение месяца после ежемесячных внутривитореальных инъекций, и можно ожидать отскок реакции. В качестве альтернативы разрабатываются стратегии генной терапии, такие как20растворимый ингибитор CD59, который в настоящее время находится в фазе I клинических испытаний. Инкапсулированные клетки также позволяют непрерывное производство биологических в течение длительных периодов времени и могут быть прекращены (т.е. explanting капсулы), если это необходимо.
На сегодняшний день мы только испытания для производства биологических в течение 6 недель14. Следует отметить, что описанный здесь метод должен использоваться только для доказательства принципа в животных моделях, а не для использования у пациентов, так как альгинатные капсулы не являются достаточно стабильными, чтобы полностью предотвратить измельчение во время инъекции и не должны длиться более нескольких недель. В отличие от этого, твердое устройство, такое как разработанный Neurotech может длиться в течение21 лет, чтобы доставить необходимые факторы22,23,24. Кроме того, этот новый метод также может быть объединен с инкапсулированной доставки наркотиков. В целом, ожидается, что эта новая область будет быстро развиваться в качестве альтернативной стратегии для повторных инъекций терапии генной терапии.
В отличие от этого, твердое устройство, такое как разработанный Neurotech может длиться в течение21 лет, чтобы доставить необходимые факторы22,23,24. Кроме того, этот новый метод также может быть объединен с инкапсулированной доставки наркотиков. В целом, ожидается, что эта новая область будет быстро развиваться в качестве альтернативной стратегии для повторных инъекций терапии генной терапии.
Subscription Required. Please recommend JoVE to your librarian.
О регенеративной медицине
Поиск Кабинет МенюО регенеративной медицине
Глубокоуважаемые коллеги,
Не так давно совпали во времени несколько уточняющих понимание современного этапа клеточных технологий, включая тканевую инженерию, публикаций. Их авторы разные люди, но, кажется, их всех одинаково не устраивает недоброкачественная около-журналистика и легкое поверхностное понимание проблем регенеративной медицины, которое, безусловно, вредят ее развитию. Что-то такое кристаллизовалось в начале декабря вокруг тканевой инженерии в разных точках планеты.
Один из апологетов тканевой инженерии Stephen Badylak (профессор хирургии, McGowan Institute for Regenerative Medicine, Pittsburgh, Pennsylvania, и заместитель редактора в npj Regenerative Medicine) 8 декабря опубликовал в Nature особое письмо – «Perspective: Work with, not against, biology». Пользователь Ден Тулинов так прокомментировал мнение профессора:
Что-то такое кристаллизовалось в начале декабря вокруг тканевой инженерии в разных точках планеты.
Один из апологетов тканевой инженерии Stephen Badylak (профессор хирургии, McGowan Institute for Regenerative Medicine, Pittsburgh, Pennsylvania, и заместитель редактора в npj Regenerative Medicine) 8 декабря опубликовал в Nature особое письмо – «Perspective: Work with, not against, biology». Пользователь Ден Тулинов так прокомментировал мнение профессора:«Против искусственных почек, трахей, мочевых пузырей и разных органов и тканей пишет в Nature профессор в McGowan Institute for Regenerative Medicine, зам. редактора журнала “Регенеративная медицина”. Против не в том смысле, что “деталь” человека, напечатанная на 3D принтере — плохо, а в том, что это тупиковый путь, временное решение. Такое, как правило, не работает. С 1990-х растет энтузиазм вокруг искусственных органов. Тканевые инженеры создают все более впечатляющие прототипы, придумывают трюки, как обмануть иммунную систему.За три дня до этого Ольга Маслова с присущей ей доброжелательностью и педантичностью разжёвывает, что такое «ложные сенсации» в регенеративной медицине. Свой текст автор заключает основополагающей фразой: «…думать, что уже завтра подобные процедуры станут массово доступными – всё же слишком наивно. Стоит подождать чуть дольше… Например, до послезавтра». Наконец, за 1,5 недели до этого – 23 ноября в Центре Москвы, на Китай городе состоялся раскованный разговор о тканеинженерной проблематике с Денисом Яцутко, который был опубликован в начале уходящей недели порталом XXII ВЕК — ОТКРЫТИЯ, ОЖИДАНИЯ, УГРОЗЫ. Новости науки и технологии. Футурология. Публицистика.Но профессор отмечает, почти все так и остаются демонстрациями, не уходя в медицину. Главная причина: орган состоит из разных типов клеток, он должен быть пронизан сетью сосудов, нервных и лимфатических путей. Каждая клетка должна поверить, что она часть организма — ей нужны правильная кислотность, механическое напряжение, концентрация кислорода, сигнальные молекулы, связи с другими клетками. Вы не можете это просто напечатать. Не говоря уже об иммунной системе — она считает искусственный орган инородным телом и атакует его. Тогда вам нужно либо постоянно её дурачить (что сложно), либо подавлять. Где же выход? Обратиться к ресурсам самого организма. Тот же аксолотль легко может отрастить заново лапу, даже часть мозга. Человек не может, но инструкции по созданию любой части тела у него есть, они “записаны в генах”. Профессор говорит: вместо того, чтобы прятаться от иммунной системы или бороться с ней, мы должны использовать ее силу. Лучшая стратегия — не создавать детали и заплатки, а найти те сигналы, что управляют регенерацией.
Тканевая инженерия будущего выглядит так: делаем “заготовку” органа, помещаем его в тело и подаем команду. Используем организм как биореактор — он делает основную работу. Автор идет не в ногу с теми, кто любит фокусы типа “на 3D принтере напечатали ухо”. Кто видит ключ к успеху в развитии технологий: вот слепили “орган”, он быстро деградирует, отторгается, но мы доведем его до ума, сделаем биосовместимым. Ведь прогресс не остановить, будут новые материалы, новые решения. Тут не поспоришь, однако это — парадоксально — взгляд из прошлого, подход ХХ века. Правда за профессором. Медицина будет уходить от грубой механики, все больше станет искать вдохновение в резервах самого организма. Здесь та же линия, о чем я писал по случаю сделки Google и GlaxoSmithKline . Повторюсь, идея глубже, чем вопрос “как заменить почку”. Речь о том, чтобы мыслить как биологи, а не как инженеры (хотя это бывает полезно). Или еще шире — изменить “объект” на “субъект”. Тканевая инженерия, электроника, импланты — будут развиваться, причем бурно и успешно.
Мы станем киборгами, о чем я и сам писал. Но это будет связано больше с усилением, расширением наших возможностей, взаимодействием с техносредой. То, что умеет организм, лучше отдать ему, не делать его работу. По кр. мере до тех пор, пока мы от организма не откажемся (во что я в обозримом будущем не верю)».
Подписаться на новостиРоман Деев, директор по науке ПАО «Институт Стволовых Клеток Человека».
На недавно опубликованное у нас интервью с Еленой Губаревой о положении дел в регенеративной медицине директор по науке Института Стволовых Клеток Человека Роман Деев отреагировал скептической репликой на своей странице в Facebook. Мы решили побеседовать с Романом, чтобы узнать его точку зрения на перспективы тканевой инженерии. XX2 ВЕК. Роман, когда у нас вышло интервью с краснодарцами, Вы так весьма скептически у себя в «Фейсбуке» заметили, что высказывание о том, что мы идём в ногу с Америкой и Европой, слишком оптимистично. Почему? Роман Вадимович Деев. Вообще, моя стена в «Фейсбуке» достаточно скептична. Поэтому высказывание коллег из Краснодара — это не единственный случай, когда я позволяю себе, скорее, иронично отзываться о каких-то анонсах, событиях и мнениях в области регенеративной медицины. Если быть точным, я написал, что коллег из Краснодара я «нежно люблю, но зачем же терять голову»./ Рисунок — Ася Ад.
Есть некоторые основания так писать по той простой причине, что мне посчастливилось наблюдать процесс создания этой лаборатории, её развития, работу этого коллектива. Кроме того, мне приходится быть достаточно хорошо осведомлённым о том, что происходит в России в данной области науки. Абсолютно понимаю Елену и её мотивацию в этом интервью; конечно, «делать науку» — именно в кавычках произношу эти слова; «делать науку» — нехорошее словосочетание, но, тем не менее, в России заниматься биотехнологическими разработками архисложно. Тем более, в данном случае это происходит в рамках учреждения, подчинённого Минздраву, с достаточно урезанными бюджетами, поэтому работа в таких лабораториях — это «подвиг в мирное время». Это понятно, и это вызывает уважение. Но есть один нюанс: невозможно идти в ногу с зарубежными коллегами, если при этом работать на зарубежномоборудовании, реализовывать зарубежные мысли, идеи, концепции и так далее. Можно говорить о параллельном ходе в том случае, если мы работаем на отечественном оборудовании, с отечественными реактивами, потому что наука — это же не просто мысль и её реализация.
Это вообще-то инфраструктура, созданная для проведения тех или иных научных исследований. Поэтому оборудование, реактивы, стандарты организации лабораторного и исследовательского процесса, сама тема тканевой инженерии в том виде, в котором она у нас воспроизводится — это же не наши идеи, давайте уж по-честному!? Это всё-таки имплантировано, перенесено к нам, как в своё время с Запада Пётр Первый переносил какие-то идеи, какие-то форматы. То же самое касается регенеративной медицины. Конечно, важные открытия, важные заслуги в этой области, безусловно, есть и у нас, но если говорить конкретно про контент сегодняшнего дня, давайте уж будем честными и откровенными, мы воспроизводим всё то, что однажды было кем-то сделано на Западе. Обогащая, совершенствуя, но по сути ведь нет же ни одной технологии, полностью своей. XX2 ВЕК. То есть, догоняющая стратегия? Р. Д. Разумеется. Понимаете, в чём дело: регенеративная медицина (в современном её понимании) — это пятнадцать-двадцать лет истории и работы; а лабораториям в Российской Федерации, которые могли быть созданы в рамках некоего инновационного тренда, который был при формировании политики инновационного развития, сколько? Десять лет? Восемь? Как вы хотите идти в ногу, когда мы в два раза отстаём чисто хронологически? Я не говорю про технологическое отставание.
Чудес не бывает. Я не хочу говорить «догоняем — не догоняем», у каждого свой путь; видимо, мы идём своим путём, но надо понимать, что это «не в ногу», это мнение — самообман. С Еленой, мы с ней это интервью не обсуждали… Но, ведь это читают люди, и они могут сделать неправильные выводы из прочитанного. С другой стороны, это было мнение одного эксперта. У меня другое мнение. Я не готов выступать в качестве ментора или поправлять чужое профессиональное мнение. XX2 ВЕК. А по поводу высказывания Елены о том, что впереди сейчас страны Азии, Китай, что можете сказать? Р. Д. Смотря в чём… А мы рецензируем то интервью, да? У нас такой формат беседы?
XX2 ВЕК. Почему нет? Для начала. Интересна же точка зрения другого эксперта.
Р. Д. Хорошо. Смотря что считать критерием, что считать мерилом. Если мерило — это количество публикаций, то, конечно, миллиард китайцев, всяко, их напишет больше. Я говорю условно, но из миллиарда выборка учёных больше, чем из миллиона, даже из трёхсот миллионов в Евросоюзе или США.Их просто математически больше. Если смотреть на прорывы, то пока не видно, чтобы количество переходило в превосходное качество. Появляются классные работы, но эти классные работы являются всё-таки творческим переосмыслением и развитием того, что сделано на Западе. CRISPR/Cas9 не придумали в Китае. Их воспроизвели, их смелее начали использовать по ряду причин, но не в странах Азии их придумали. XX2 ВЕК. А собственно это более смелое использование не значит, что Китай, может быть, как раз обгоняет? Р. Д. Нет, конечно. Объясню, почему. Потому что есть другой критерий, который называется «трансляция в клинику». Одно дело технология, другое дело — её исследование, доводка, подводка, третье дело — доклиническое исследование, четвёртое дело — внедрение в клинику. И если мы посмотрим на историю биотеха внимательно, то вспомним, что есть два геннотерапевтических препарата, зарегистрированных в Китае, и они же первые на планете — Oncorine и Gendicine, 2003 и 2005 годы, но это американские патенты.
Просто их было удобнее зарегистрировать в Китае. Там было быстрее провести клинические исследования, видимо на тот момент дешевле. Но получается, что это не китайская разработка. XX2 ВЕК. Регистрация в Китае даёт возможность использовать их где-то ещё? Р. Д. Нет, конечно, не даёт. Только в рамках того регулятора, который регистрировал. Регистрировала FDA (у них тоже FDA это называется) Китая, значит только в Китае и используются, если нет иных межгосударственных соглашений. Если посмотреть на зарегистрированные и одобренные национальными регуляторами технологии, будь то генные, будь то клеточные, то, безусловно лидируют (может быть, пока) страны Запада. Если посмотреть на количество клинических исследований, — опять же, чисто математически, количественно, — то начинается конкуренция между Западом и Востоком в этом аспекте. Есть ли «выхлоп» из этого количества на сегодняшний день? Пока его нет. Если посмотреть на законодательство, судя по всему, самое осмысленное, сбалансированное и friendly к разработчикам законодательство вообще в маленькой Японии.
Поэтому ответ на Ваш вопрос пока не может быть однозначным. С точки зрения лабораторной части, да, наверное, страны Азии количеством побеждают, прежде всего, за счёт Китая. С точки зрения качества и выхода для медицины, пока преждевременно делать выводы об азиатском лидерстве в регенеративной медицине. Мы два-три года слышим мнения о том, что вот-вот китайское количество перейдёт в качество. Наверное, в технике это происходит, но в биотехе пока нет. XX2 ВЕК. А в плане чего количество может перейти в качество? Чего ожидают от китайцев? Р. Д. Да ничего особенного. Воспроизведения и быстрого проведения клинических исследований западных технологий. XX2 ВЕК. Это всё? Р. Д. Это моё оценочное суждение. Генную терапию не придумали в Китае, CRISPR/Cas9, коррекцию генома тоже не придумали в Китае. Когда китайская научная индустрия начнёт действительно генерировать технологии? Чёрт его знает. Пока не генерирует. Пока только заимствование и творческое развитие и переосмысление. XX2 ВЕК. По-вашему, когда можно ожидать в России или даже в мире реально используемых тканеинженерных органов для лечения людей? Р. Д. А зачем? XX2 ВЕК. Что значит — «зачем»? Разве они не нужны? Р. Д. Понимаете, у нас есть такой стереотип, что это очень нужно. XX2 ВЕК. А разве нет? Не ждать донора… Р. Д. Это всё красивые журналистские сказки, на самом деле. Они очень хороши для научпопа, очень неплохи для получения и реализации грантов, но для жизни, как показывает опыт, они далеки не то что от реализации, но даже от смысла этой реализации. Я здесь скептиком делаюсь. Да, наверное, существуют единичные аппликации, где это имеет смысл, но я вообще не думаю, что человечество пойдёт этим путём. Это вечная журналистская весёлая история, которая берёт начало, мне кажется, из карикатур прошлого (если не позапрошлого) века, когда доктор приходит в аптеку и берёт с полки печень, почки, селезёнку… Это всё не технологично. Мы с вами одинаково понимаем термин «тканевая инженерия»? Может быть, мы его понимаем по-разному? В классическом понимании, тканевая инженерия — это использование некоего матрикса, некое каркаса (скаффолда), синтетического или естественного, на который мы «посадили» клетки. И они, такие умные, «сели» туда, размножились и превратились в то, во что надо пациенту и врачу. Но мы же видим, что это не работает. Это не работает даже для таких качественно простых вещей, как костная ткань. Простых — насколько живая ткань вообще может быть простой. А уж для таких сложных, многокомпонентных структур как пищевод, трахея, лёгкое, печень — это вообще не путь. С научной точки зрения — это, конечно, интересное направление; а с практической — путь утилизации денежных знаков, не более того. XX2 ВЕК. Но пытаются же в этом направлении что-то сделать. Вы считаете, что у всего этого будущего нет? Р. Д. Много чего пытаются сделать, но это же не значит, что из этого всё получится. У подавляющего большинства разработок тканевой инженерии будущего, конечно, нет. Они будут вытеснены гораздо более эффективными и технологичными подходами ещё до момента фактического перехода в клиническую практику. XX2 ВЕК. Например, какими? Р. Д. Например, интересная технология, у всех на слуху, это, конечно, биопринтинг. Там катастрофическое количество проблем, и сейчас трудно делать прогнозы в этом плане, но в принципе она выглядит гораздо интереснее, чем тканевая инженерия. А то, что называется «дёшево и сердито» и что действительно позволяют биотехнологии — это, конечно, выращивание гуманизированных животных. Потому что это понятно и это относительно дёшево. XX2 ВЕК. Гуманизированные животные — это животные, которым подсажены человеческие ткани? Р. Д. В том числе. На самых ранних этапах эмбриогенеза. Впрочем, набирающие обороты технологии коррекции генома могут побороться с экспрессией антигенов. Вырастить свинью, с неиммуногенным подходящим по размеру сердцем, которое можно брать и трансплантировать, может оказаться гораздо дешевле, чем вырастить псевдосердце из псевдокардиомиоцитов на псевдокаркасе, активировать там псевдоэлектрическую систему электрического сопряжения для координированных сокращений этих псевдокардиомиоцитов; запустить туда псевдокоронарные сосуды, которые это всё будут кровоснабжать… Ещё раз говорю: это красиво для научной фантастики, это очень «прикольно» для научпопа и это недурно работало в прошлом десятилетии для получения грантов. Но к концу этого десятилетия на это даже гранты перестанут давать, потому что уже понятно, что это мыльный пузырь. XX2 ВЕК. По-моему, пересадка свиного сердца человеку выглядит не менее фантастично. Р. Д. Да нет, технологии есть, прототипы гуманизированных животных уже лет десять как существуют, над этими технологиями умные компании работают, доведут скоро, надеюсь. XX2 ВЕК. И не будет отторгаться? Р. Д. Вы у меня спрашиваете, как у бабушки Ванги. В теории, в идеологии этой технологии именно это свойство и заложено, иначе смысла не было бы. Любой организм животный — гораздо более дешёвый и гораздо более эффективный биореактор, чем все технологические навороты, которые используются, все эти ухищрения с наполовину промышленными, наполовину подвальной сборки биореакторами, всё это, к сожалению, и это тоже всего лишь личное оценочное суждение, не технологично. Это сиюминутно, для совершенно конкретных форм околонаучного бизнеса. XX2 ВЕК. А какие в таком случае есть перспективные направления для использования стволовых клеток? Р. Д. Мы всегда должны называть вещи своими именами. Вы о каких стволовых клетках спрашиваете? Потому что, например, есть гемопоэтические стволовые клетки, и мы не можем говорить о перспективах, так как они полстолетия широко используются в клинике. Первая их аллогенная трансплантация — 1964—68 годы, потом 90-й год — за это Нобелевская премия. Слава тебе господи, онкогематология, наследственные заболевания с гематологическим синдромом именно так и лечатся — гемопоэтическими клетками костного мозга и пуповинной крови, для восстановления повреждённого или уничтоженного кроветворения. И, в общем, вопросов к этому нет. Есть разные формы совершенствования этой методики, направленные на более эффективное подавление иммунной системы перед трансплантацией, методики обогащения трансплантата гемопоэтическими стволовыми клетками, подращивание этих клеток в условиях in vitro. Это всё есть, да, но концепция — вот она; и полстолетия работает. Но если мы говорим о других видах стволовых клеток, то там ситуация иная, нельзя их всех рассматривать «в кучке». Поэтому, если Вы сможете сформулировать, какие стволовые клетки Вас интересуют, то постараюсь ответить. XX2 ВЕК. Я не специалист, но знаю, что сейчас много говорят, например, о плюрипотентных стволовых клетках. Р. Д. Вы имеете в виду iPS, да? Клетки с индуцированной плюрипотентностью. Если Вы обратили внимание, то даже начатые клинические исследования с применением этого материала посвящены лечению генетического заболевания (генетический дефект клеток пигментного эпителия сетчатки). Это та нозология, которая требует, с одной стороны — восполнения погибших или погибающих клеток того же организма, то есть они должны быть аутогенными, с другой стороны — клетки пациента должны быть генетически исправлены, доведены до этапа iPS лабораторным путём, затем их надлежит куда-то направить по пути дифференцировки, в данном случае в сторону пигментного эпителия. Но ведь ниша генетических болезней — это очень небольшая область медицины; редкие болезни. Это значит — экономические издержки от разработки таких методов могут быть столь велики и неокупаемы, что они могут стать фактором риска того, что собственно широкой трансляции в клиническую практику для рутинного применения не получится. XX2 ВЕК. То есть, Вы думаете, что в это просто перестанут вкладываться? Р. Д. Генетические болезни по-другому радикально не лечатся. Их нужно лечить путём исправления генов и эффективной доставки исправленного генетического материала. Здесь эта технология кажется — говорю осторожно — кажется действительно выигрышной в сравнении со всеми остальными возможностями. Пока особой альтернативы нет, кажется, что это должно срабатывать. Но каждый раз это будет индивидуальный и персонифицированный подход. И кто заплатит за такое лечение? XX2 ВЕК. Нет альтернативы? А CRISPR/Cas9? Р. Д. Да, но их доставить же надо по месту назначения. Вы его по вене-то не пустите. Это ж не препарат системного действия, их как таблетку не съешь и не пойдёшь дальше. Эти конструкции нужно как-то доставить в организм, в ткани и клетки. Элементарный пример — наследственная патология мышечной ткани миодистрофия Дюшенна, страшное заболевание. Берём CRISPR/Cas9, вы что его три раза в день после еды будете принимать по столовой ложке? Как вы его доставите в каждое мышечное волокно? У взрослого 40 кг мышечной ткани; ладно, у ребёнка пусть 10—15 кг. Как вы в эти сотни миллионов волокон, внутрь, поместите исправляющую мутацию конструкцию и исправите таким образом ген дистрофина? Мы сами это не сделаем, не сможем. Эту тонкую процедуру должны выполнить мобилизованные нами клетки-помощники. Пускай, это будут iPS, например, которые в исправленном виде можно трансплантировать, рассчитывая на то, что они донесут нужную информацию в нужное место, моделируя, заставляя/обучая их её доносить. Конечно, это вопрос технологии, как это реализовать. И здесь такая технология как раз абсолютно выигрышная, потому что пока не просматривается никаких альтернатив, которые могли бы её заменить. XX2 ВЕК. Несколько лет назад в СМИ и соцсетях много говорили о том, что в дорогих клиниках, в которых лечатся богатые люди, всем подряд и от всего подряд колют стволовые клетки. Это о чём, о каких клетках? Что им кололи? Р. Д. Предлагаю спросить прокуратуру об этом. Потому что, если всем подряд что-то кололи, предполагаю, что где-то в недрах прокуратуры должны храниться десятки томов уголовных дел. Вы слышали хоть об одном уголовном деле на эту тему? XX2 ВЕК. Это какой-то развод был, видимо? Р. Д. Не развод, но такая, жареная тема. Почему бы не написать об этом пару статей в каком-нибудь таблоиде. Прикольно же. XX2 ВЕК. То есть, возможно, и не было ничего? Р. Д. Знаете, конечно, недобросовестные люди есть в любом деле. Есть недобросовестные водители троллейбусов, наверное, есть недобросовестные работники завода, на котором делают ракеты. Наверняка есть и недобросовестные люди в белых халатах, никуда от этого не деться. Поэтому вполне допускаю, что в своё время существовали организации, которые этим занимались, но я вас уверяю: их никогда не существовало в таком количестве, как нам об этом говорили, в том числе и чиновники Минздрава. Я помню эти цитаты, мне приходилось присутствовать на разнообразных заседаниях, слушаниях, в Госдуме, чёрт-те где, где даже представители Минздрава, не буду называть фамилии, утверждали, что чуть ли не в каждом подвале колют плюрипотентные клетки. Конечно, такого не было, это всё чепуха. А отдельные факты если и были, то по ним должны были бы сохраниться материалы административных и уголовных расследований. Ну покажите. XX2 ВЕК. Значит, если это было, это было скорее преступление? Р. Д. Если там нарушено законодательство, то как это иначе квалифицировать? Было преступление или нет, может определить, наверное, суд, но, скажите — хоть что-то дошло до суда? Хоть одно вообще дело, хоть одно разбирательство было? Ребята, давайте оперировать фактами. Где? Кто? Когда? Да, конечно, можно зайти в интернет, погуглить, и вы найдёте клинику в Швейцарии. Эта страна не входит в Евросоюз, поэтому там себе позволяют всякое. Они, допустим, лечат многие болезни, клиника Пауля Ниханса, клетками загадочной чёрной горной овцы. То есть, это использование ксеногенных клеток. У них даже русскоязычная страница есть. Вот, может, у них там в Швейцарии и нарушается закон… XX2 ВЕК. Овцы? Р. Д. Овцы. Чёрной, горной. XX2 ВЕК. Как эти клетки-то вообще с человеческим организмом взаимодействуют? Р. Д. Так, как и положено ксеногенным клеткам. Должны погибнуть. Должны вызвать какие-то гуморальные и иммунные реакции. Но опять же, он их 50 лет применял, Пауль Ниханс. Судя по тому, что пишут, многие известные люди были клиентами этой клиники, некоторые папы римские, Чарли Чаплин. Это всё вполне можно найти в доступных источниках на русском языке. И, в общем, клиника работает, насколько я понимаю вполне успешно. XX2 ВЕК. Но это же шаманство? То же самое, что и, например, всякая парфюмерия, как бывает, знаете, на упаковке написано: «Крем со стволовыми клетками берёзы»? Только что не «стволовые клетки ствола берёзы». Р. Д. Ну шаманство отчасти, да… Что касается косметических дел, это маркетинг. «Стволовые клетки берёзы», ну и ладно, мало ли что напишут. Что касается этой клиники, тут, шаманство не шаманство, нельзя сбрасывать со счетов некое неспецифическое воздействие на организм реципиента. Попадают чужеродные клетки, бодрится иммунная система, начинаются гормональные какие-то сдвиги, какой-то период это работает… Я предполагаю сейчас, я не утверждаю. Потому что у меня нет опыта исследований, я не видел ни одной публикации. Честно говоря, внимательно не смотрел, но вот так вот мне не попадалось за пятнадцать лет публикаций по системному введению ксеногенных клеток, от животных человеку. В моём представлении ничего хорошего от этого быть не должно. Но нельзя сбрасывать со счетов, ещё раз повторю, и какую-то неспецифическую реакцию организма, которая действительно может изменить в некоторых ситуациях статус организма, баланс болезни и здоровья. Насколько надолго, в какую сторону? Но опять же, мы же не видели, в общем, ни одного судебного разбирательства за эти несколько десятков лет. XX2 ВЕК. Все довольны, видимо? Удивительно… Чёрт, вы так срезали, я так хотел поговорить о тканеинженерных органах… Р. Д. Можем, конечно, пофантазировать на эту тему. XX2 ВЕК. Но ведь постоянно появляются сообщения: вырастили то, вырастили сё, на каркас подсадили… Р. Д. Ничего не вырастили. Никто ничего нигде не вырастил, понимаете? Дело ведь в том, что вы эти сообщения читаете в интерпретации пресс-служб университетов или русскоязычных журналистов, что ещё хуже. Я обезличенно говорю, но просто очень часто, когда повторяют/пересказывают одну и ту же новость через три колена, да ещё с нехорошим английским переводом, то конечный итог, публикуемый в России, радикально отличается от того, что было на самом деле. Поэтому не верьте просто тому, что слышите, вот и всё. Никакой орган ещё никто никогда нигде не вырастил. Как вырастит, отпразднуем, откупорим бутылочку шампанского. XX2 ВЕК. Буквально на днях была новость о том, что выращен кишечник и даже с нервной тканью. Р. Д. Вырастить орган можно только внутри организма. Его нельзя вырастить за пределами организма. Можно создать некий биоартифициальный эквивалент. Даже не аналог. Где будет неживая строма, то есть каркас, на который «село» клеток на два-три-четыре-пять порядков меньше, чем их на самом деле находится в единице объёма любой живой ткани. Эти клетки находятся в отрыве от нервной регуляции, в условиях in vitro — в отрыве от гуморальной регуляции, и не нужно фантазировать: они не «садятся» качественно на предлагаемый в качестве каркасов субстрат; они не выстраивают качественную ткань, этого ничего не происходит. XX2 ВЕК. А что происходит? Р. Д. В какой момент? В момент in vitro? Или в тот момент, когда их подсаживают в организм? In vitro ничего не происходит. Живут они и живут. Для них создаются условия, им тепло, влажно, кислород, витаминки — всё есть, они себе живут. Клетки можно культивировать на поверхности, в чашке, а можно в трёхмерной системе. Для этого, допустим, используются специальные мембраны, чтобы можно было увеличить площадь поверхности и можно было в одном флаконе выращивать больше клеток. Естественно, в условиях более интенсивного обмена среды и газов. А можно вместо этих сложных губчатых или мембранных фильтров, на которых выращивают большие объёмы клеток, предложить этим клеткам матрикс и сказать: «А это матрикс для тканевой инженерии». Суть не поменяется: некоторые клетки «садятся» и живут. Ну, может быть, некоторые размножаются, где-то что-то синтезируют. В итоге получается, что на трёхмерном неживом каркасе существует, иногда в полслоя, иногда в один слой, иногда в несколько слоёв, какое-то количество клеток. Как правило, это клетки соединительнотканной природы, как правило, для этого используют мультипотентные мезенхимальные стромальные клетки, те, которые мы называем ММСК, или, как иногда говорят, МСК, — ну и что? Представьте, что есть такое медицинское изделие. Можно сверху наслоить эпителиальных клеток, тогда по поверхности поползёт какой-то эпителий. И замечательно, и это всё, что происходит in vitro. Да, ещё можно подействовать какими-то химическими или биологическими агентами и индуцировать направленную дифференцировку. Но не нужно думать, что будет расти кость, если мы направляем это в остеогенную сторону. Нет, там выпадут маленькие-маленькие крошечки минерала, кристаллики, которые видны только под микроскопом, микроскопические преципитаты фосфатов кальция. Будут так же минорные молекулярные признаки идущей костной дифференцировки. Вот что будет в подавляющем, абсолютном большинстве случаев и абсолютном числе таких технологий. Что происходит при помещении такого изделия in vivo? Во-первых, как поместить его in vivo? Чаще всего это операция. Операция — это травма, это рана; на это организм реагирует воспалением, миграцией, агрессией лейкоцитов, оксидацией, выработкой провоспалительных цитокинов, то есть, добрая половина пересаженного материала погибает тут же. Дальше возникает вопрос кровоснабжения — они, ведь, кушать хотят. In vitro им богатую и дорогую питательную среду по трубочке подавали, а тут они попали в операционное ложе, даже сосудов нет. Если это орган, который должен перистальтировать, или сердце, то существенное значение имеет развитие ещё вегетативной нервной системы, интрамуральных нервных сплетений, должна произойти интеграция с системой нервной регуляции. Эти сказки, о том, что клетки такие умные и после пересадки сами знают, что делать, это всё мы уже проходили в 90-х годах и в начале 2000-х, в экспериментах, когда их просто вводили. Была такая мысль, что они сами придут по механизму хоуминга, по градиенту концентрации некоторых веществ в нужное место и там всё сделают… Да, действительно, этот эффект направленной миграции показан в огромном количестве статей, что по градиенту цитокинов клетки, даже после системного введения могут мигрировать туда, где им вкусно пахнет, где концентрация каких-то аттрактантов больше, единичные из них действительно могут во что-то дифференцироваться. Единичные! Как правило, на организменном уровне, в клинической картине заболеваний этот «приход» клеток вообще не сказывается. В основе этого лежит то, что после пересадки каких-то тканевых эквивалентов, даже в экспериментах на животных, если их проводить корректно, чаще всего происходит либо полная, тотальная гибель пересаженного клеточного материала, либо субтотальная. Каким образом на это реагирует организм? Все наши патоморфологические реакции на такого рода вмешательства известны и стереотипны; и давным-давно описаны в учебниках: рассасывание, инкапсуляция, прорастание соединительной тканью, нагноение… Идеальный случай, когда процесс рассасывания пересаженного (имплантированного) материала происходит одновременно с замещением своими тканями с краёв раны (операционной раны). Допустим, костные хирурги никогда не фантазируют на эту тему. Все разработчики костных материалов как раз эту цель и закладывают в идеологию своих разработок и честно об этом говорят: мы хотим создать такой материал, чтобы скорость его рассасывания соответствовала скорости роста рядом расположенной кости, чтобы процесс был уравновешен. Проблема в том, что пока химикам-технологам не удаётся это сделать, минерал слишком долго не рассасывается, подбирают комбинации — минерал, минерал плюс клетки — не для того, чтобы они стали какой-то выдающейся костью, а для того, чтобы они способствовали этому балансу скоростей обоих процессов. В остальных областях хирургии пока ещё коллеги не готовы признаться (в первую очередь себе), что и в других тканях действует тот же принцип: все заплатки на пузыри, все заплатки на трубчатые органы (кишка) — это тоже рассасывание с замещением. Да, в отличие от синтетических материалов, которые для этого используются, в тканевой инженерии процесс может быть более точным, по скорости более синхронизированным, с одной стороны. С другой стороны, есть материалы биологического происхождения, они используются, они есть на рынке, имеются в виду разнообразные заплатки, получаемые из перикарда, из фасций и др., они применяются несколько десятков лет, чуть ли не столетие. Активно используются в хирургической практике, и замечательно, и хорошо. Конечно, есть какие-то случаи, где не получается, я не готов огульно распространить это на весь организм, есть сложные области, где пока это не получается сделать. Если прорасти насквозь не удаётся, то вторая стереотипная реакция организма на пересадку тканеинженерной конструкции — это обойти препятствие, обрасти и инкапсулировать. Это следующий вариант: заключить в соединительнотканную капсулу. Поэтому, когда мы восстанавливаем какие-то тканевые элементы, части органов, где функционально ведущей тканью является эпителий, то при удачном стечении обстоятельств он просто растёт поверх, вот и всё. Это не те клетки, которые находились в этом биоартифициальном эквиваленте. Это свои клетки организма, это же не в вакууме всё происходит, вокруг конструкции всегда есть живые ткани. Уверен, что для подавляющего большинства случаев тканевой инженерии, мы начнём скоро об этом говорить. Сейчас пока стесняемся. Регулярно посещаю все форумы, смотрю, слушаю. Десять лет уже мы об этом не говорим, но чувствуется, что пора. Пора раскрывать карты и переставать морочить голову. Это не значит, что у этих технологий нет будущего или нет каких-то минорных аппликаций. Есть какие-то: есть пищевод, есть трахея; но, во-первых, это не значит, что и там нет альтернатив, они там есть. Да, тканевая инженерия — это интересный подход; можно поиграть, попробовать, посмотреть — в доклинических исследованиях, прежде всего. Но в принципе каких-то мощных аппликаций для тканевой инженерии я пока не вижу. XX2 ВЕК. Выходит, ко всем сообщениям о том же выращенном кишечнике с нервной тканью, о том, что выращена искусственная вагина на некоем каркасе, стоит относиться как к пустому хвастовству? Р. Д. Вот смотрите: берут каркас, сеют клетки там — гладкомышечные; получается трубка. Если её вшить на место удалённой или неразвившейся вагины, будет трубка, замещающая вагину. Можно сказать, что это вагина, что ли? Чем дольше эта трубка стоит на этом месте, тем интенсивнее в неё начинают прорастать нервы, нарастает соединительная ткань, нарастает свой эпителий — так это ж свои, это же не мы присадили и подшили нервы какие-то… Вагина, может, не самый удачный пример… XX2 ВЕК. В пресс-релизе говорилось, что это для женщин с недоразвитием влагалища и что это довольно часто встречающаяся проблема. Р. Д. Не часто, далеко не часто (1 случай на 5000—20000 девочек). Кроме того, пластические, реконструктивные хирурги делают вагины из фрагмента кишечника и из других собственных тканевых материалов. На сегодняшний день научились трансплантировать даже матку, более того — даже и рожать после этого. Поэтому, вагина, с точки зрения науки — интересно. С точки зрения практики — зачем? XX2 ВЕК. Меня предупреждали, что вы скептик… Р. Д. Но что настолько! (смеётся) Это удивительно, на самом деле. Каждый раз, когда иду разговаривать с учёными, обычно настроен на что-то такое: «Давайте поговорим о будущем, о том, как всё будет прекрасно». Но нет. В противочумном говорят, что последние штаммы оспы никогда не уничтожат; Александр Каплан говорит, что мозг — слишком сложная материя, и мы никогда его не воспроизведём; Вы говорите, что тканеинженерных органов никогда не будет, — грустно. Р. Д. Ну Вы же знаете: пессимист — это хорошо информированный оптимист. XX2 ВЕК. Хотелось бы всё-таки светлых нот. А что хорошего происходит? Р. Д. Да жить хорошо. Солнце светит. Небо голубое. Своим делом заниматься прекрасно. Больным помогать. Разрабатывать и внедрять новые методы — вообще великолепно. XX2 ВЕК. И какие есть интересные новые методы в плане применения стволовых клеток? Р. Д. Каких? Опять спрашиваю: каких? Я (это, опять же, субъективно) с большим интересом жду результатов именно по лечению генетических заболеваний с использованием технологии iPS. Это исследования, которые начались с замещения атрофированного пигментного эпителия в сетчатке. Чрезвычайно интересно. Здесь, как уже говорил, нет альтернативы, и мы впервые получили молекулярную отмычку для этой проблемы. Это может оказаться очень мощным прорывом. Да, таких больных немного. Но вчера они были приговорены, а сегодня появилась технология, дающая им свет. В большинстве других случаев такого критического перепада «вчера-сегодня» нет. Замещают трахею, но её и так замещали. Хуже или лучше — мы смотрим на статистику по результатам и не можем сказать, что предыдущие методы были сильно хуже тканеинженерных. А вот в случае сетчатки не было ничего вообще. Вообще, когда происходит прогресс — это сразу видно. Например, технология iPS, первые работы — шестой год (2006), потом восьмой год, и, считайте, через шесть лет — Нобелевская премия! То есть, очевидно, что технология дала нам какой-то новый серьёзный инструмент. Не всегда так, конечно, происходит с Нобелевским комитетом, очень часто Нобелевский комитет консервативен, но, тем не менее, здесь это совершенно чётко видно. А вся эта чудесная тканевая инженерия… Ну, сколько ей? Ну, 20 лет? Где прорывы-то? Какую проблему решили за 20 лет? XX2 ВЕК. А есть ещё такие вдохновляющие примеры? Когда вчера ничего, а сегодня прорыв? Р. Д. ЭКО. Экстракорпоральное оплодотворение. До 78 года ничего, а с 78-го — пожалуйста. XX2 ВЕК. А посвежее? Р. Д. Посвежее, будьте любезны, CRISPR/Cas9. Этой технологии два-три года, на самом деле, именно в том варианте, в каком она есть сейчас. А уже начались клинические исследования, представляете? XX2 ВЕК. В Китае уже пытаются… Р. Д. Там даже да, уже коррекцию эмбриона делают. XX2 ВЕК. Взрослого ракового больного ещё пытаются лечить с помощью CRISPR. Р. Д. Прекрасно. Если получится — замечательно. Появилась ещё усовершенствованная мощнейшая технология по обучению лимфоцитов, натаскиванию их на злокачественные опухоли. То, что мы не можем сделать другими способами, технология химерных антигенных рецепторов. XX2 ВЕК. CAR-T? Р. Д. Да, да. И тут же пошли клинические исследования. Вот это мощнейшие вещи, они всегда на стыке тончайшей прикладной молекулярной биологии и трансплантологии. А клетки на каркасах можно ещё 15 лет растить. Для студенческих работ вполне сгодится, ну для дипломных — интересно же. XX2 ВЕК. Но ведь выращиванием тканеинженерных органов очень много лабораторий занимается по всему миру. Р. Д. Ну и что? XX2 ВЕК. Они все, все эти сотни, наверное, учёных занимаются чепухой? Р. Д. Разные лаборатории работают с разной мотивацией. Кто-то сел на свой конёк, у кого-то это хорошо получается, гранты дают — ну грех не пользоваться. Наука — это такой же способ зарабатывания и приношения денег в семью. Кто-то действительно искренне полагает, что вот сейчас мы что-то вырастим и пришьём, и оно прирастёт. У кого-то не хватает фантазии придумать что-то другое. У кого-то опыта не хватает. Кто-то начальству хочет угодить. У всех разная мотивация. XX2 ВЕК. Мне всё же хочется быть оптимистом. Не просто ведь засевают клетками. Появляются сообщения, что там прорастили сосуды, там прорастили нервную ткань… Р. Д. Слышу такие сообщения десять лет; до некоторой степени я — в теме. Одиннадцать лет редактор профильного научного журнала, как вы знаете, и я это слышу все эти годы. Наверняка это всё и до меня ещё говорили, но я этого не слышал, потому что был маленький. Ну, слушайте, сосуды растили в условиях in vitro от момента начала исследований in vitro, то бишь с начала XX века, когда уже системно начали культивировать ткани, например, соединительную ткань. Ну и росли там сосуды, почему бы им не расти? Сто лет они растут основные клетки сосудов — эндотелий, сто десять — если быть точным; они растут in vitro — и что? Первая русская монография по культивированию соединительной ткани — одна тысяча девятьсот шестнадцатый год. Первый выпуск журнала, который называется «Русский архив анатомии, гистологии и эмбриологии». Издатель — профессор А. С. Догель, Петроградский уже, университет, но пока ещё Императорский. Монография профессора А. А. Максимова. И у него там это показано, и эндотелий показан… XX2 ВЕК. И ожидания… Р. Д. Ожидать — можно. Ждите. XX2 ВЕК. А вот когда говорят о биоискусственных органах — это что-то другое? Тоже недавно были новости: биоискусственная селезёнка, биоискусственная печень… Р. Д. Я не знаю. Это слово — «биоискусственный» — под ним можно подразумевать чёрт знает что. С этим надо разбираться, что имеется в виду. Что касается селезёнки, понимаете, в чём дело… Вот смотрите, достаточно частая травма среди молодых слегка половозрелых ребят, особенно военнослужащих срочной службы — это отрыв селезёнки или разрыв капсулы селезёнки. В этих случаях приходится её удалять, потому что оставить или ушить опасно, чревато кровотечением. Архитектура селезёнки такова, что она состоит из трёх компонентов: каркас (так называемая строма), а дальше, в определённом трёхмерном порядке, лимфоциты, это клетки, которые не выстраивают какую-то системную ткань, они растут узелками, тут размножились — шарик, тут размножились — шарик, а всё остальное — это погибающие эритроциты. Просто мешок с погибающими эритроцитами. «Кладбищем эритроцитов» её из-за этого называют. Какой-то выдающейся 3D-структуры, от которой бы зависела функция, там нет. Что делали раньше старые мастера? Я уж не знаю, делают сейчас или нет. Считается, что селезёнка нужна в молодом возрасте — для становления лимфопоэза и так далее, и так далее. У человека старшей возрастной группы её просто убирают, просто вы-бра-сы-ва-ют. В тазик. А молодым людям стараются сохранить. Но просто оставить её нельзя и ушить тоже нельзя. Потому что это орган без чёткой внутренней структуры, его тут зашьёшь, а тут расползётся. Поэтому что делали? Брали кухонную тёрку, стерильную разумеется, брали селезёнку, натирали её, перетирали, прямо на операции, в фарш. Брали сальник, есть у нас такое образование в животе, тоненькая плёночка двухслойная, где висят жировые образования, делали из сальника в нескольких местах мешочки, просто нитку пропускали и, как кисет, затягивали — и внутрь этот фарш. Фарш стерилен. Там что? Мёртвые эритроциты, погибающие, и лимфоциты, которые постепенно там формировали новые маленькие селезёночки. В результате у парня была не одна большая селезёнка в левом подреберье, а десять маленьких селезёночек, и лимфоциты продолжали жить и выполнять свою функцию. Так что про селезёнку лучше даже не рассказывать. Селезёнка — это вообще лапша на уши про тканевую инженерию. Несерьёзно. С печенью да, печень — сложный орган с точки зрения 3D-архитектуры. Чудовищно сложный. Потому что гепатоциты, клетки печени, так поляризованы нестандартно, что с одной стороны они должны вырабатывать желчь и выпускать её в желчный проток, с другой стороны осуществлять детоксикацию, с третьей стороны они должны синтезировать белки и выбрасывать их в кровь, всё это должно правильно кровоснабжаться, то есть очень сложная система ангиоархитектуры. Плюс ещё ко всему этому должна быть соединительная ткань, на которой вся эта сложная конструкция держится. Никто нигде никогда этого ещё не воспроизвёл и скорее всего не воспроизведёт. Вырастить слой гепатоцитов и назвать это искусственной печенью или вырастить гепатоциты на губке или на шариках и назвать это искусственной печенью или биоискусственной печенью — это не значит воспроизвести фрагмент органа, это неправда. Никто, нигде и никогда по технологии тканевой инженерии не сделал этого, и скорее всего не сделает. XX2 ВЕК. Федеральный центр трансплантологии, который в районе «Октябрьского поля», пару лет назад ещё объявлял о создании биоискусственной печени. Р. Д. А вы посмотрите повнимательнее, о чём они говорили. Они публикуют работы, как правило, про экстракорпоральную искусственную печень. Это гепатоциты, которые выполняют часть функций, находясь в специальных колонках за пределами организма. Это один вариант. Второй вариант, с которым они работали, это берётся строма, то есть, соединительнотканный каркас, и на него засеваются гепатоциты. Ну да, они могут жить в трёхмерном пространстве, но это же не значит, что они функционируют как печень, что они одним концом вырабатывают желчь, другим вырабатывают белки, третьим осуществляют детоксикацию. Да нет, конечно. Обыватели склонны верить тому, что слышим. Мы склонны думать, что если говорят про биоискусственную печень, то это, бац, килограмм такой, и её можно взять и пришить. А журналисты склонны не разбираться до конца, в том, что они слышат. А некоторые учёные склонны несколько преувеличивать. И так рождается миф. Это вам рецепт рождения мифа. Даже организм не умеет нормально восстанавливать печень. Это сказки, что стоит отрезать и… Вот орёл прилетал, там, к Прометею и выклёвывал, а у того всё отрастало… Да, конечно, у грызунов она неплохо регенерирует, очень хорошо. С человеком так не получается. Вы отрежете кусок печени, и фактически ничего потом не произойдёт. Будет какая-то гипертрофия через какое-то время, небольшая гиперплазия, но в принципе ничего не произойдёт. Вспомните ситуацию с циррозом, когда часть гепатоцитов, часть печёночных долек погибает, на их месте начинают формироваться эпителиальные узлы, то есть, молодые гепатоциты или их предшественники, гипотетическая стволовая клетка печени, которую никто ещё пока не нашёл, не идентифицировал, может развиваться, но проблема в чём — формируются эти узлы молодых, новообразованных гепатоцитов, но даже внутри организма к ним не подводятся сосуды и из них не выходят желчные протоки. И эта катастрофа называется цирроз печени, от этого умирают. Потому что, хоть и есть гепатоциты, но функцию свою они при такой трёхмерной организации выполнить не могут. Ни тебе детоксикации, ни тебе белкового синтеза. XX2 ВЕК. Картина всё грустнее и грустнее. Р. Д. Пора. Пора ложку честности влить в эту бочку патоки, которую слышим уже больше десяти лет.
6225
Дата: 19 декабря 2016 г.
© При копировании любых материалов сайта, ссылка на источник обязательна.
Подняться вверх сайта
Encapsulation — обзор | ScienceDirect Topics
6.3 Эффекты инкапсуляции одиночных ферментов
Было показано, что инкапсуляция одиночных ферментов в VLP приводит ко многим полезным свойствам с точки зрения повышения применимости ферментов в качестве полезных и функциональных катализаторов. В некоторых случаях было показано, что VLP усиливают растворимость рекомбинантных белков, которые в противном случае локализованы в телец включения (Patterson et al., 2013a). Было показано, что VLP повышают устойчивость к протеазной, термической и химической денатурации (Fiedler et al., 2010). Кроме того, инкапсуляция VLP обеспечивает средства иммобилизации ферментных катализаторов на поверхностях или материалах без прямой иммобилизации фермента, что, как было показано, снижает активность во многих случаях (Rodrigues et al., 2013; Sheldon, 2007).
Также небезосновательно ожидать, что ферменты, инкапсулированные в пределах белковой клетки, могут проявлять повышенную кинетику. Структуры, динамика и механизмы внутриклеточных ферментов развивались в очень тесной среде (Ellis, 2001).Существует вероятность того, что восстановление элементов этой среды выявит аспекты поведения ферментов, которые не проявляются в разбавленных растворах, в которых они обычно изучаются. К сожалению, инкапсуляция одним ферментом на сегодняшний день в значительной степени не способствует улучшению кинетики. За одним исключением, Cornelissen и соавторы продемонстрировали повышенную активность PalB, инкапсулированного в VLP CCMV, по сравнению со свободным ферментом (Minten et al., 2011). Было обнаружено, что активность PalB была максимальной, когда только одна копия фермента была инкапсулирована в VLP CCMV.По мере увеличения количества PalB и плотности инкапсуляции активность приближалась к активности свободного PalB. Эти данные свидетельствуют о том, что не повышенная плотность инкапсуляции приводит к усилению катализа PalB, а вместо этого некоторые эффекты, специфичные либо для клетки CCMV, либо для PalB.
В большинстве случаев инкапсуляции с одним ферментом не наблюдается изменений или снижается каталитический оборот после инкапсуляции. Инкапсуляция дрожжевой цитозиндезаминазы в SV40 несколько снижала активность, хотя кинетические параметры не исследовались подробно (Inoue et al., 2008). Финн и соавторы обнаружили, что инкапсуляция снижает активность пептидазы E (PepE) (Fiedler et al., 2010). Одним из наиболее драматических изменений в обороте было семикратное снижение после инкапсуляции термофильного AdhD в P22 (Patterson et al., 2012).
Единственным примером значительного увеличения оборота одного фермента является инкапсуляция гетеродимерной гидрогеназы Escherichia coli NiFe в VLP P22 (рис. 10). Дуглас с соавторами продемонстрировали, что совместное капсулирование обеих субъединиц гидрогеназы приводит к 100-кратному увеличению производства водорода (Jordan et al., 2016). Обращение к этой системе как к единственному ферменту может вводить в заблуждение, поскольку гетеродимерная природа фермента, вероятно, ответственна за резкое увеличение наблюдаемой активности. Этот фермент существует в природе в виде двух разных мембраносвязанных субъединиц, которые связаны на поверхности мембраны. Исследования растворимых доменов этого фермента показали, что он нестабилен и склонен к инактивации кислородом. Кроме того, взаимодействие димеров в растворе динамично (Jordan et al., 2016).Когда гидрогеназа изучается как разбавленный растворимый фермент, гидрогеназа полностью вырывается из ее естественного контекста, возможно, в большей степени, чем естественно свободные растворимые ферменты, используемые во многих других исследованиях инкапсуляции ферментов VLP. Инкапсуляция в системе P22 SP приводит к высоким локальным концентрациям обеих субъединиц, которые не могут выйти из капсида, и, следовательно, ассоциация субъединиц с образованием активного гетеродимера является предпочтительной.
Рис. 10. Инкапсуляция гетеродимерной гидрогеназы внутри P22 VLP приводит к более чем 100-кратному увеличению оборота фермента.На слева представлена схема продукции гена в этой системе, показывающая продукцию двух субъединиц гидрогеназы ( красный и зеленый ) в виде слияния с каркасом P22 (SP желтый ) и последующую экспрессию оболочки P22 (CP синий ), позволяющий складывать и созревать груз перед герметизацией. Эта стратегия защищает и усиливает груз, о чем свидетельствует увеличение производства водорода, показанное на графике реакции справа, где оптимизированный инкапсулированный образец ( красный, ) резко превосходит свободный фермент ( зеленый ) и неоптимизированную инкапсулированную конструкцию (). синий ).
Рисунок взят из Jordan, P.C., et al., 2016. Самособирающиеся биомолекулярные катализаторы для производства водорода. Nat. Chem. 8, 179–185.Одним из недостатков оценки кинетики этих систем VLP и ферментов в целом, основанной исключительно на обороте, является то, что оборот может быть резко изменен, если процент ферментов в анализе, которые действительно являются активными, изменяется. Это тонко особенно очевидно в случае гидрогеназы (Hyd-1), инкапсулированной в P22, где непосредственно измеряли как оборот, так и количество интактных активных центров.После инкапсуляции оборот и количество интактных активных сайтов увеличиваются, что позволяет предположить, что увеличение обмена частично связано с увеличением процента активных ферментов (Jordan et al., 2016). Увеличение оборачиваемости выгодно для использования ферментов в качестве функциональных катализаторов независимо от происхождения этого увеличения. Однако с точки зрения механики представляет интерес различать кинетические изменения, возникающие в результате увеличения процента активного фермента в популяции, и изменения конформации или окружающей среды каждого фермента, которые также могут изменять кинетическое поведение.
Изменения кажущейся константы Михаэлиса-Ментен ( K M прибл. ) для инкапсулированной ферментной системы не зависят от концентрации и дают некоторое представление о кинетических эффектах, которые могут возникать в инкапсулированной среде с высокой плотностью. K M app значения были зарегистрированы для нескольких ферментных систем, обсужденных ранее. Инкапсуляция люциферазы внутри Qβ показала большие изменения в K M app для АТФ и люциферина, с почти 10- и 20-кратным увеличением, соответственно, для наиболее загруженных конструкций, и показала положительную корреляцию с увеличением количества инкапсулированных ферментов (Fiedler et al., 2010). Альтернативно, инкапсуляция фермента PepE в Qβ не показала изменений в K M app с двукратным меньшим оборотом. Инкапсуляция AdhD в P22 показала пониженные значения для ацетоина в инкапсулированной форме K M app , несмотря на более низкий оборот (Patterson et al., 2012). Изменения в K M app кофактора NADH, используемом AdhD, показали очевидное увеличение в два-три раза после инкапсуляции, хотя эти различия были трудно разрешить статистически.
Эти примеры показывают, что существенные различия возникают из-за инкапсуляции VLP ферментным и потенциально клеточно-зависимым образом. Исследования переполненности, использующие агенты скопления для создания условий скопления людей, сообщили о различных кинетических изменениях, как увеличении, так и уменьшении в K m , а также значениях текучести. Что касается решения, исследования краудфандинга имеют то преимущество, что они позволяют более легко использовать такие методы, как круговой дихроизм, для отслеживания изменений в структуре ферментов в многолюдной среде (Eggers and Valentine, 2001; Jiang and Guo, 2007; Sasahara et al., 2003; Токурики и др., 2004). Получение структурной информации необходимо в исследованиях краудинга, чтобы установить убедительные связи между краудсингом ферментов и кинетикой. Мониторинг структуры ферментов в VLP-инкапсулированной среде является сложной задачей из-за большого фонового сигнала от белков клетки. Такие методы, как резонансная передача энергии Фёстера, использовались в VLP-инкапсулированных системах для измерения степени скученности, но, насколько нам известно, не применялись к инкапсулированным ферментным системам (O’Neil et al., 2012). Кроме того, реконструкции с помощью цироэлектронной микроскопии и механические исследования с использованием АСМ могут обеспечить связь между структурными изменениями и кинетическими эффектами.
Внутренние концентрации ферментов в обсуждаемых здесь исследованиях варьируются от 0,5 мМ до 7 мМ, что значительно выше, чем обычно используется в биохимических кинетических исследованиях. Хотя количество исследований все еще ограничено, кажется, есть четкие указания на то, что влияние на оборот и K M app для этих инкапсулированных систем является специфическим для ферментов.Заметный успех инкапсуляции одним ферментом в стабилизации и защите ферментного груза предполагает, что наиболее повсеместным применением этой технологии является продление срока службы ферментов в качестве полезных катализаторов. Вдобавок впечатляющая способность восстанавливать нерастворимые ферменты или заведомо нестабильные ферменты путем связывания в VLP предполагает, что инкапсуляция одного фермента для улучшения кинетики лучше всего направлена на печально известные трудные в обращении ферменты, а не на модельные ферменты с хорошим поведением, которые преобладали в исследованиях. до сих пор (Jordan et al., 2016; Паттерсон и др., 2013). Дополнительный потенциал для кинетического усиления основан на способности инкапсулировать несколько последовательных ферментов в один и тот же капсид.
Почему инкапсуляция является (или должна быть) королем
Много раз было сказано, что форма капсул облегчает их глотание, чем таблетки — и есть другие в отрасли, которые придерживаются противоположного мнения. Я не скрывал свою принадлежность выше, так что вы, вероятно, догадались, в чем моя приверженность! Лекарственные формы для перорального применения бывают всех форм и размеров.Будь то капсула, жидкость, порошок, гранула или таблетка — каждая из них играет определенную роль в доставке лекарств. Но что, если бы мы могли объединить две формы в одну? Вместо того, чтобы повторять старые соображения о том, какая дозировка лучше, я хотел бы сосредоточиться на обсуждении того, почему инкапсуляция, возможно, более перспективна, чем таблетки. Одним из ключевых преимуществ капсул является их способность заполняться жидкостью — и эта технология поддается некоторым важным тенденциям в API.
Во-первых, хотя твердые лекарственные формы обычно хорошо воспринимаются пациентами, многие новые химические соединения относительно нерастворимы в водной среде, что приводит к медленному и неполному растворению в кишечной среде.Жидкие лекарственные формы в виде раствора или суспензии помогают решить проблемы с растворимостью, но их не всегда удобно принимать. На мой взгляд, капсулы, наполненные жидкостью, предлагают лучшее из обоих миров. И причина, по которой я начал работать с капсулами, заполненными жидкостью, заключалась в том, что я твердо убежден, что преимущества этой технологии не были полностью использованы. Жидкий состав, предназначенный для инкапсулирования, сохраняет удобство и простоту пероральной доставки твердой лекарственной формы. Многие находящиеся сегодня в разработке соединения плохо растворимы и требуют технологии повышения биодоступности.Во многих случаях составы на основе липидов могут значительно улучшить растворимость API — и дисперсии или суспензии лекарственных средств в липидных носителях или подходах с растворителями и сорастворителями можно легко инкапсулировать либо в капсулы, либо в мягкие гели.
Во-вторых, я считаю, что жидкие составы также хорошо подходят для решения проблем, связанных с составлением и безопасным обращением с высокоактивными API (HPAPI), которые составляют все большую часть промышленных трубопроводов. Лекарства с высокой эффективностью обеспечивают терапевтическую эффективность при низких концентрациях.Но хотя это может быть клинически выгодным, они также усложняют процессы разработки и производства лекарств. Требуемая доза HPAPI очень мала — иногда менее миллиграмма — и может быть проблемой добиться однородности дозы. Для обеспечения равномерного содержания HPAPI в каждой таблетке, например, требуется тщательный выбор соответствующих вспомогательных веществ, тщательные исследования смешивания в каждом масштабе производства и мониторинг десегрегации порошка, что может привести к значительной вариабельности от дозы к дозе.В некоторых случаях компаниям приходилось прекращать производство определенных продуктов, потому что они просто не могли добиться воспроизводимости доз. Защита безопасности оператора — еще одна ключевая проблема на всех этапах разработки продукта, и, на мой взгляд, технология жидкого наполнения сводит к минимуму возможность воздействия на оператора по сравнению с обращением с твердыми активными ингредиентами.
Примером продукта с низкой дозировкой, который имеет проблемы с эффективностью и биоэквивалентностью, которые помог решить жидкий состав, является левотироксин.Левотироксин был предметом обзора MHRA Великобритании в 2013 году, в котором был сделан вывод о сложности производства таблеток левотироксина. В результате потенциальной чувствительности продуктов левотироксина к незначительным изменениям в технологии обработки, производство продуктов левотироксина следует рассматривать как «нестандартное», несмотря на использование традиционных технологий смешивания, гранулирования и прессования. И здесь у капсулы, наполненной жидкостью, есть шанс засиять. Заполненные жидкостью капсулы могут вмещать низкие дозы с хорошей воспроизводимостью от дозы к дозе, поскольку лекарство, находящееся в растворе (или хорошо составленной суспензии), является гомогенным, без возможности расслоения во время заполнения капсулы или хранения продукта.Пример левотироксина представляет собой отличное тематическое исследование, в котором было показано, что технология твердых капсул с жидким наполнением способна создавать составы этого лекарства с хорошей воспроизводимостью дозы, что позволяет избежать ошибок, связанных с таблетками левотироксина.
Я уверен, что ясно, что я увлечен потенциалом технологий твердых капсул с жидким наполнением, но они являются лишь одной из многих лекарственных форм, которые могут помочь доставить ингредиенты в организм наилучшим образом. На самом деле, есть некоторые случаи, когда таблетки, пеллеты, жидкости или порошки могут превосходить капсулу.Однако разработка лекарств становится все более сложной, и я думаю, что отрасли стоит обратить внимание на передовые технологии. В частности, важно выбрать решение, которое наилучшим образом соответствует характеристикам API, соответствует целевому профилю продукта, помогает обеспечить безопасность оператора и, в конечном итоге, обеспечивает наилучший терапевтический результат для пациентов.
Стивен Браун — управляющий директор Capsugel, Эдинбург, Великобритания.
Способы инкапсуляции и свойства капсул
Скачать версию PDF
Активные фармацевтические ингредиенты (API) часто вводятся в виде водных растворов или суспензий, а фармакокинетика в первую очередь определяется концентрацией лекарственного средства или размером частиц.Иногда рецептура требует таких свойств, как маскировка вкуса, физико-химическая защита хрупких API и расширенное высвобождение API. Микрочастицы и наночастицы, содержащие API, являются одним из методов, используемых для достижения этих свойств. Еще одно применение этой технологии — создание комбинированного лекарственного препарата с двумя разными API, несовместимыми с другим.
Наполнители, используемые для приготовления таких частиц, включают полимеры (обычно сложные полиэфиры, такие как сополимер L-молочной и гликолевой кислоты) и поликапролактон, липиды (обычно фосфолипиды, триглицериды и натуральные воски) или нерастворимые соли и оксиды металлов, такие как диоксид кремния. , фосфат кальция и карбонат кальция.
В этом техническом обзоре основное внимание уделяется способам приготовления и характеризации микрокапсул с лекарственным средством с двумя типами морфологии: матричный и ядро-оболочка. Микрокапсулы матричного типа имеют API, равномерно распределенный по микрокапсуле, а микрокапсулы типа ядро-оболочка имеют внешнее покрытие, внутри которого заключен API (см. Рисунок 1). Кроме того, различные процессы и свойства получаемых ими капсул приведены в таблице 1.
Матричные микрокапсулы для литья и измельчения растворителем
Простым способом приготовления микрокапсул матрицы, нагруженных АФИ, является растворение АФИ и образующего частицы наполнителя в растворителе, удаление растворителя с получением слоя наполнителя, содержащего лекарственное средство, а затем измельчение плиты для получения порошка лекарственного загруженные частицы.Летучие органические растворители должны быть удалены из конечного продукта до приемлемо безопасного уровня. В случае липидных наполнителей отливка плиты из смеси API и расплавленного наполнителя позволяет избежать использования растворителей. Если АФИ растворим в наполнителе, то в результате измельчения плиты образуются однородные частицы, в противном случае может возникнуть неоднородное распределение. Это можно свести к минимуму, сначала микронизируя API до размера, намного меньшего, чем конечная желаемая микрокапсула.
Процессы распыления
Альтернативный метод получения частиц из раствора API и наполнителя — распылительная сушка.Во время этого процесса раствор API / наполнитель / растворитель распыляется через нагретое сопло в камеру, где растворитель испаряется из капель с образованием твердых частиц (см. Рисунок 2) 1 . Растворитель восстанавливается для утилизации или повторного использования, а частицы собираются в циклоне. Частицы обычно имеют приблизительно сферическую форму и имеют размер от 1 до 50 мкм. Для наполнителей матрицы, плавящихся при относительно низких температурах, таких как воски и липиды, можно использовать охлаждение распылением без растворителей.
Во время этого процесса API и вспомогательные вещества совместно расплавляются и распыляются в расплавленной форме через сопло, и частицы затвердевают при охлаждении. Распыление в условиях ламинарного потока из вибрирующего сопла дает частицы с очень узким распределением по размерам.Процессы на основе эмульсии
Для нерастворимых в воде API раствор API / наполнитель / растворитель может быть эмульгирован в водный раствор поверхностно-активного вещества с использованием стандартного в отрасли оборудования для эмульгирования, такого как лопастные смесители с подвесным потолком, гомогенизаторы ротор-статор и встроенные статические смесители.Точного контроля размера капель можно достичь с помощью методов эмульгирования, таких как эмульгирование с тангенциально-поточной мембраной (TFM), микрофлюидика и вибрационные форсунки 2 . Эмульсии получают с помощью TFM, продавливая органическую фазу через поры мембраны, отделяя ее от тангенциально текущей фазы водного эмульгатора. Скорость потока и размер пор, форма, угол и химический состав поверхности определяют размер и распределение капель. Вибрационные сопла и микрофлюидные устройства также могут образовывать частицы с очень узким распределением по размерам.Во всех процессах на основе эмульсий органический растворитель должен быть относительно нерастворимым в воде и предпочтительно иметь низкую температуру кипения для легкого удаления. Метиленхлорид часто является предпочтительным растворителем, хотя также используется этилацетат, поскольку он легко удаляется разбавлением из-за его более высокой растворимости в воде (~ 8%) и имеет более низкую токсичность, чем хлорированные растворители. Если используются наполнители, образующие частицы с низкой температурой плавления, расплавленный наполнитель / фаза API может быть эмульгирован, и твердые липидные микрокапсулы образуются при охлаждении без использования органических растворителей.
В родственном процессе микрокапсулы на основе альгината могут быть изготовлены без использования каких-либо органических растворителей. Водный раствор альгината натрия, содержащий API, капают в раствор ионов Ca2 +. Ионы двухвалентных металлов заставляют растворенный альгинатный полимер превращаться в гель и образовывать частицы. Этот процесс даже использовался для инкапсуляции живых клеток и бактерий 3 .Экструзия горячего расплава (HME)
API и термопластические наполнители могут быть тщательно перемешаны без растворителя при высоком сдвиговом усилии и повышенной температуре с использованием совместно вращающихся шнеков экструдера горячего расплава.Экструдированная лента может быть подвергнута микропеллетизации, измельчению или сферонизации для получения конечных частиц, содержащих АФИ. Таким образом получают микрочастицы API / микрокристаллической целлюлозы для заполнения желатиновых капсул.
Поскольку частицы матрицы содержат API, однородно распределенный по всей частице, материал на поверхности может слишком быстро высвобождаться, разрушаться или приобретать неприятный вкус, и высвобождение не является постоянным с течением времени. Частицы ядро-оболочка обеспечивают больший контроль.
Микрокапсулы типа «ядро-оболочка»
Микрокапсулы ядро-оболочка полезны, когда на поверхности частицы не требуется активного материала.Это может быть для маскировки вкуса, химической защиты активного вещества или контроля кинетики высвобождения. Для перорального применения покрытие частиц API наполнителем, который нерастворим в желудке, но растворим при повышенном pH нижнего отдела кишечника, может высвобождать API там, где это необходимо. Для энтеросолюбильных покрытий используются вспомогательные вещества, такие как акриловые полимеры Eudragit ™ и фталат ацетата целлюлозы. Оболочки можно наносить на твердые или жидкие ядра.
Покрытие распылением и покрытие поддонов
Простейшая микрокапсула типа ядро-оболочка — это частица активного вещества, покрытая наполнителем.На частицы API можно нанести покрытие путем распыления раствора или суспензии наполнителя в псевдоожиженный слой, заполненный частицами ядра 4 . Таблетки могут быть инкапсулированы в энтеросолюбильные полимеры путем распыления на них раствора или дисперсии энтеросолюбильного покрытия в V-образном смесителе или путем нанесения покрытия на поддон, когда таблетки перемешивают в горячей «сковороде», содержащей расплавленные наполнители для покрытия.
Полимер, отделяющий фазы от раствора
На частицыAPI можно нанести покрытие путем осаждения растворенного полимера на поверхность совместно диспергированных частиц API, чему способствует снижение температуры или добавление нерастворителя полимера.Полиизобутилен используется в качестве индуктора синфазности и конечного стабилизатора частиц. 5 . Микрокапсулы, содержащие жидкие ядра, обычно получают из эмульсий типа масло-в-воде.
Способы капсулирования капель
Коацервация
Капли эмульсии масло-в-воде покрыты полиэлектролитами (такими как желатин и гуммиарабик) путем коацервации. При определенных pH и концентрациях полимеры образуют комплекс, который покрывает капли эмульсии, которые могут быть химически отверждены с образованием оболочки
Межфазная полимеризация
Мономеры, растворенные в каплях масла, могут реагировать с другими, растворенными в водной фазе, с образованием стенки на границе раздела.Наиболее распространены стены из полиуретана, полиэстера и полиамида. Капли также можно инкапсулировать путем полимеризации мочевины и формальдегида, растворенных в водной фазе.
Разделение фаз в эмульсиях
Удаление низкокипящего органического растворителя из эмульгированных капель, содержащих растворитель, полимер, образующий оболочку, активный ингредиент и высококипящий нерастворитель, может дать микрокапсулы при удалении низкокипящего растворителя, если эмульгатор выбран правильно 6 .
Концентрические форсунки
То же самое вибрирующее сопло, обсуждавшееся ранее, можно настроить для получения монодисперсных частиц ядро-оболочка. Сопло концентрически выровнено внутри второго сопла, и материал ядра выбрасывается из внутреннего сопла, в то время как материал оболочки выбрасывается из внешнего сопла (рис. 3). Сушка полученных капель дает микрокапсулы типа ядро-оболочка.
Заключение
Encapsulation предоставляет разработчикам фармацевтических препаратов универсальный и коммерчески проверенный метод создания рецептур.Он может быть полезен как для промежуточных, так и для конечных продуктов, когда приходится сталкиваться с пероральной доставкой API-интерфейсов с неприятным вкусом, хрупких API-интерфейсов или объединением двух несовместимых API-интерфейсов в комбинированный продукт. Инкапсуляция также становится все более популярной для лекарственных форм длительного действия для расширенного выпуска API.
Список литературы
- Формулирование систем доставки лекарств с помощью распылительной сушки, Мария-Инес Ре, Технология сушки: Международный журнал, 1532-2300, 24, (4) 433-446 (2006)
- Процесс мембранного эмульгирования — обзор, Charcosset, Limayem I., Фесси Х., Журнал химической технологии и биотехнологии, 79 (3) 209-218 (2004)
- Инкапсуляция молочнокислых бактерий в гранулах альгината кальция для производства бактериоцина, Эвелина Иванова, Валентина Чипева, Искра Иванова, Ксавье Дуссе, Дени Понселе, Журнал коллекций культур, 3 53-58 (2000-2002)
- Качественное описание процесса нанесения покрытия в псевдоожиженном слое на основе Вурстера, Норринг Кристенсен и П. Бертельсен, Разработка лекарств и промышленная фармацевтика, 23 (5) 451-463 (1997)
- Микрокапсулирование путем разделения фаз этилцеллюлозы: характеристики микрокапсул, Chemtob, J.К. Чаумей, М. Н’Донго, Международный журнал фармацевтики, 29 (1) 1-7 (1986)
- Получение микрокапсул из поли (метилметакрилата) с жидкими сердцевинами, Локсли, Винсент Б., Journal of Colloid and Interface Science, 208 (1) 49-62 (1998)
(PDF) Важность инкапсуляции в фармацевтической сфере, как это делается и вопросы экстракции трав
7
безопасная доставка лекарств. Лекарства подвержены удалению, разложению, инактивации, потере
, а также неспецифическим проблемам с плохой адсорбцией.Это основные факторы, с которыми сталкиваются
исследователей, особенно при доставке терапевтических агентов, таким образом, иммобилизация с помощью инкапсуляции
преодолевает большинство проблем пероральной доставки.
2.1. Желудочно-кишечный
В инкапсулированной форме агент был более защищен при пероральной доставке, он
обеспечивает изоляцию и устраняет контакт чувствительного и активного лекарственного средства
в суровых условиях окружающей среды при пероральном пути доставки.Например, известно, что антиоксидантные агенты
очень чувствительны к суровой среде желудочно-кишечного тракта
и обладают высокой реакционной способностью по отношению к свободным радикалам. При пероральном пути доставки
, особенно во рту, желудке, двенадцатиперстной кишке, тощей кишке и проксимальных отделах подвздошной кишки, антиоксидант
подвергается воздействию свободных радикалов, ферментативной деградации и кислой среде
. Таким образом, была получена защита эпигаллокатехин-3-галлата, эпикатехина 3-
галлата, эпигаллокатехина и эпикатехина в биополимере посредством инкапсулирования.Было показано, что инкапсуляция значительно улучшает биодоступность агента
, избегая свободных радикалов и ферментативного разложения (11). Однако в инкапсулирующей системе
вместо лекарственного средства используемый инкапсулирующий биополимер подвергается
разложению в суровых условиях и, как следствие, потере переносимого агента.
Однако ему удается успешно доставить агент на целевой сайт, хотя и при более низкой концентрации
.
2.2. Гематоэнцефалический барьер
Доставка лекарств в очень отдаленные районы человеческого тела — очень сложная задача. Гематоэнцефалический барьер (ГЭБ) остается одним из очень сложных физических барьеров
для доставки лекарств (12). Тем не менее, многие заболевания, которые носят хронический характер,
связаны с функциями мозга. Эти неврологические заболевания, такие как неврологический рак
, сосудисто-нервные, нейродегенеративные и т. Д., Находятся в
областях мозга и происходят из них.Разработаны и вводятся неврологические препараты для перорального приема
Наноинкапсуляция для доставки лекарств
EXCLI J. 2014; 13: 265–286.
Опубликовано в Интернете 20 марта 2014 г.
Авнеш Кумари
1 Отдел биотехнологий, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (HP), Индия
Rubbel Singla
1 Отдел биотехнологий, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (H.P.), Индия
2 Академия научных и инновационных исследований, Нью-Дели, Индия
Аника Гулиани
1 Отдел биотехнологии, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (HP), Индия
Судеш Кумар Ядав
1 Отдел биотехнологии, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (HP), Индия
2 Академия научных и инновационных исследований, Нью-Дели, Индия
1 Биотехнология Отделение, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (H.P.), Индия
2 Академия научных и инновационных исследований, Нью-Дели, Индия
* Кому следует обращаться: Судеш Кумар Ядав, Отдел биотехнологии, CSIR — Институт технологии биоресурсов Гималаев, Палампур-176061 (HP ), Индия, электронная почта: ni.ser.tbhi@ramukhsedus; moc.liamffider@tyksПолучено 31 января 2014 г .; Принято 19 февраля 2014 г.
Это статья в открытом доступе, распространяемая в соответствии со следующим разделом передачи прав http://www.excli.de/documents/assignment_of_rights.pdf. Вы можете свободно копировать, распространять и передавать работу при условии указания автора и источника.
Эта статья цитируется в других статьях в PMC.Abstract
Наноинкапсуляция лекарств / малых молекул в наноносителях (НК) — очень многообещающий подход для развития наномедицины. Современные методы капсулирования лекарств позволяют эффективно загружать молекулы лекарств внутри NC, тем самым снижая системную токсичность, связанную с лекарствами. Нацеливание на NC может усилить накопление нанокапсулированного лекарственного средства на пораженном участке.В этой статье основное внимание уделяется методам синтеза, загрузке лекарственного средства, механизму высвобождения лекарственного средства и клеточной реакции наноинкапсулированных лекарств на липосомах, мицеллах, углеродных нанотрубках, дендримерах и магнитных НК. Также использование этих различных NC было выделено в области нанотехнологий.
Ключевые слова: наноносители, липосомы, мицеллы, дендримеры, углеродные нанотрубки, магнитные
Введение
Наноинкапсуляция терапевтических агентов увеличивает их эффективность, специфичность и направленность (Soppimath et al., 2000 [120]). Наноносители (NC) защищают свою полезную нагрузку от преждевременной деградации в биологической среде, повышают биодоступность и продлевают присутствие в крови и поглощение клетками (Kumari et al., 2010 [76], [77]). В литературе описаны многие методы синтеза NC (Galindo-Rodriguez et al., 2004 [40]). Способы синтеза выбираются в зависимости от химической структуры терапевтического агента, типа применения (Alonso, 2004 [7]) и времени удержания в организме (Peer et al., 2007 [105]).НК разного размера могут быть синтезированы с использованием разных матриц (Dobrovolskaia and McNeil, 2007 [32]). Размер и распределение NCs по размеру важны для определения их клеточного поглощения и проникновения через биологические барьеры (Kumari and Yadav, 2011 [75]). Размер и химия поверхности NCs определяют их характеристики in vivo и (Suri et al., 2007 [122]). Механизмы высвобождения лекарственного средства одинаково важны из состава лекарственного средства-NC из-за предлагаемого применения в доставке лекарств (Yoo et al., 1999 [141]). Механизм высвобождения также можно модулировать в зависимости от природы терапевтического агента и типа NC (Yadav et al., 2013 [137]).
Обычные NC выводятся из организма с помощью мононуклеарной фагоцитарной системы (MPS). MPS распознает NC как инородные частицы и быстро удаляется из системного кровотока (Storm et al., 1995 [121]). Однако, если требуется длительное присутствие в крови, поверхность NC легко модифицируется, чтобы предотвратить фагоцитоз (Storm et al., 1995 [121]).Поверхность NC также модифицируется для увеличения их способности к нацеливанию и доставки лекарственного средства в целевой участок. Поверхностная модификация NC осуществляется либо меткой лиганда (Weissleder et al., 2005 [130]), либо гидрофильными полимерами (Gref et al., 1995 [45]) на их поверхности. Поверхностный заряд — еще один важный параметр, который влияет на клеточный ответ NC (Verma and Stellacci, 2010 [128]). НК с катионным зарядом эффективно поглощаются отрицательно заряженными клеточными мембранами по сравнению с нейтральными или положительно заряженными (Muñoz Javier et al., 2006 [97]).
Интеллектуальное проектирование NC с учетом целевого сайта и пути введения решит проблемы, с которыми сталкиваются терапевтические агенты. В последующих заголовках мы обсудили влияние наноинкапсулирования различных лекарств на липосомы, мицеллы, углеродные нанотрубки, дендримеры и магнитные НК. В этой статье основное внимание уделяется влиянию различных терапевтических агентов на инкапсуляцию в различных NC и их влиянию на контролируемое высвобождение, поверхностные характеристики и клеточный ответ.
Липосомы
Липосомы представляют собой сферические везикулы с фосфолипидным бислоем, которые широко используются для доставки лекарств и генов. Липосомы защищают терапевтические агенты от деградации, доставляют их в сайт-мишень и достаточно универсальны, чтобы позволять маркировать небольшие молекулы для направленной доставки (Felnerova et al., 2004 [35]). Липосомы синтезируются с использованием катионных липидов, анионных липидов или нейтральных липидов в зависимости от способа использования и препарата, который нужно инкапсулировать. Липосомы, состоящие исключительно из заряженных липидов, могут не подходить для доставки лекарств, поскольку они не образуют заряженных везикул, способных захватывать молекулы лекарства (Shi et al., 2002 [116]).
Синтез липосом
В литературе описано множество методов синтеза липосом. Они кратко обсуждаются здесь.
Метод экструзии поликарбонатной мембраны
В этом методе липид, растворенный в хлороформе, сушится в тонкую пленку. Затем высушенную липидную пленку добавляют к буферному раствору, содержащему интересующую молекулу лекарственного средства. Липидный раствор обрабатывают ультразвуком, сушат вымораживанием и подвергают 10-кратной экструзии через поликарбонатную мембрану с размером пор 100 нм с образованием липосом.С помощью этого метода формируются липосомы одинакового размера (Shi et al., 2002 [116]).
Гомогенизация под высоким давлением
Гомогенную смесь липидов получают путем растворения их в органических растворителях, шоковой заморозки в жидком азоте и сублимационной сушки смеси. Затем лиофилизированный липид растворяют в PBS и подвергают гомогенизации под высоким давлением с образованием липосом.
Метод обращенно-фазового испарения
Липиды, растворенные в смеси хлороформа и метанола, сушат до получения тонкой пленки.Затем высушенную липидную пленку растворяют в водной фазе диэтилового эфира и обрабатывают ультразвуком с образованием гомогенной эмульсии масло в воде (мас. / Мас.). Затем органический растворитель выпаривают под вакуумом (Gareipy et al., 2002 [41]).
Метод обработки ультразвуком
Вкратце, липиды, растворенные в хлороформе, сушат в тонкую пленку и затем суспендируют в буфере трис-HCl. Полученные многослойные везикулы затем обрабатываются ультразвуком в ультразвуковом аппарате типа ванны с образованием однослойных пузырьков (Nakagawa et al., 2007 [98]).
Метод экструзии ультразвуком для гидратации липидной пленки
Раствор липидов в органическом растворителе сушат до получения тонкой пленки.Высушенную липидную пленку затем гидратируют в сульфате аммония, обрабатывают ультразвуком в ультразвуковой ванне и последовательно экструдируют через поликарбонатную мембрану с желаемым размером пор (Xiong et al., 2005 [135]).
Инкапсуляция различных типов лекарств
Лекарства добавляются непосредственно в липидный раствор для образования липосом, нагруженных лекарством. Эффективность инкапсуляции рассчитывается косвенно путем измерения количества лекарственного средства в супернатанте с помощью спектрофотометра УФ-видимого диапазона и ВЭЖХ. В липосомы инкапсулированы различные типы лекарств для повышения их эффективности и специфичности.
Противораковая молекула метотрексата была инкапсулирована во внутренней водной фазе липосом. Более 90% метотрексата оставалось в липосомах при хранении в течение 24 часов при 4 ºC (Konigsberg et al., 1998 [73]). Другой препарат доксорубицин используется для лечения рака мочевого пузыря, желудка, яичников, легких, щитовидной железы и других. Но было обнаружено, что его использование связано с токсичностями, такими как желудочно-кишечная миелосупрессия, алопеция и мукозит. Это было преодолено путем инкапсуляции доксорубицина в липосомы, которая увеличила время удерживания и снизила токсичность доксорубицина (Kale et al., 2012 [61]). В другом исследовании доксорубицин загружали в стерически стабилизированные липосомы. Введение доксорубицина, загруженного в стерически стабилизированные липосомы с трансплантатом RGD, значительно замедляет рост опухоли (Xiong et al., 2005 [135]). N-бутилдезоксиноджиримицин используется для ингибирования тирозиназы в клетках меланомы. N-бутилдезоксиноджиримицин был успешно загружен на чувствительные к pH липосомы, состоящие из диолеоилфосфатидилэтаноламина и холестерилгемисукцината. Липосомы, чувствительные к pH, снизили дозировку, необходимую для ингибирования тирозиназы, в 1000 раз (Costin et al., 2002 [29]).
Ципрофлоксацин также был успешно загружен на липосомы с эффективностью загрузки 45%. Скорость высвобождения инкапсулированного ципрофлоксацина модулировалась добавлением цистеина к дитиобензилуретановой связи между липидом и ПЭГ в липосомах (Karathanasis et al., 2005 [62]). Противогрибковый агент клотримазол был успешно инкапсулирован в нетрадиционные липосомы. Клотримазол, инкапсулированный в липосомы, проникает через кожу лучше, чем свободный клотримазол (Maheshwari et al., 2012 [89]). Третиноин использовался при лечении различных кожных заболеваний, таких как псориаз, угри, эпидермотропные и Т-клеточные лимфомы. Но использование третиноина в качестве лекарственного средства ограничено из-за низкой растворимости в воде, раздражения кожи и высокой нестабильности в присутствии воздуха, света и тепла. Таким образом, третиноин был инкапсулирован в липосомы. Отрицательно заряженные липосомы значительно улучшают удержание третиноина в коже (Sinico et al., 2005 [119]).
Поверхностная модификация липосом
Основным недостатком липосом является их неспецифическое взаимодействие с макромолекулами и клеточными поверхностями, что приводит к их короткому периоду полураспада.Обычные липосомы быстро очищаются макрофагами мононуклеарной системы (MPS), особенно клетками Купфера в печени и макрофагами селезенки. Этот недостаток можно преодолеть путем покрытия поверхности липосом гидрофильными полимерами, такими как PEG. Покрытие ПЭГ на поверхности липосом создает стерический барьер (Kale et al., 2012 [61]). Нацеливание липосом на определенные сайты может быть достигнуто путем пометки лигандов на поверхности липосом. Моноклональные антитела, лиганды и пептидные последовательности могут быть прикреплены к поверхности липосом для адресной доставки (Felnerova et al., 2004 [35]).
Загрузка и высвобождение лекарства из липосом
Лекарство находится во внутренней части липосом. Эффективная инкапсуляция лекарства является важным требованием для успешного применения липосом при доставке лекарства. В литературе сообщается о многих методах инкапсулирования, которые варьируются в зависимости от типа лекарственного средства и типа липосомальной композиции. Загрузка лекарственного средства в липосомы может быть достигнута путем пассивной и активной загрузки. При пассивной загрузке высушенная липидная пленка регидратируется в присутствии лекарственного средства с образованием липосом, нагруженных лекарственным средством (Colletier et al., 2002 [28]). При активной загрузке лекарство загружается на готовые липосомы через концентрацию или трансмембранный градиент pH (Abraham et al., 2004 [1]).
Механизм высвобождения можно модулировать путем эффективной комбинации функциональных головных групп, липидных цепей и линкерных групп в компонентах мембраны для контролируемого высвобождения инкапсулированного материала в определенных условиях. Механизм высвобождения в липосомах может происходить по четырем механизмам. Первый механизм включает pH-зависимую нейтрализацию заряженных функциональных групп компонентов мембраны (Ellens et al., 1984 [33]). Второй механизм включает pH-зависимый гидролиз незаряженных компонентов, интегрированных в мембраны (Guo and Szoka, 2001 [47]). Третий механизм включает тиолиз дисульфидных связей, присутствующих в липидах мембран. Тиолиз происходит за счет изменения окислительно-восстановительного потенциала окружающей среды, например, при перемещении с внеклеточной поверхности в цитоплазму (Zhang et al., 2004 [143]). Четвертый механизм использует температуру для высвобождения лекарства. Этот механизм используется термочувствительными липосомами для высвобождения лекарства (Lindner et al., 2004; Needham and Dewhirst, 2001 [99]).
Клеточный ответ липосом
Поглощение липосом клетками происходит по эндоцитарному пути. Важной стратегией является прикрепление лиганда к поверхности липосом, который будет прикрепляться к его рецепторам на поверхности клетки или во внеклеточном матриксе клетки. Липосомы, меченные лигандами, подвергаются клеточному захвату посредством рецептор-опосредованного эндоцитоза (Shao et al., 2006 [115]). В одном исследовании изучали адгезию простых, ПЭГилированных липосом и липосом с привитым конканвалином к модельным мембранам.Простые липосомы проявляли неспецифическую адгезию к липидным мембранам. Степень мембранного взаимодействия увеличивалась, когда простые липосомы были трансплантированы лектином (Bakowsky et al., 2008 [14]). Липосомы, конъюгированные с N-ацетилглюкозамином, демонстрируют большее взаимодействие с кардиомиоцитами in vitro (Aso et al., 2007 [10]). Липосомы с привитым человеческим рекомбинантным интерлейкином-2 показали рецептор-опосредованный эндоцитоз в линии Т-клеток CTLL-2 мыши (Konigsberg et al., 1998 [73]).
Полимерные мицеллы
Полимерные мицеллы привлекли внимание в качестве наноразмерных носителей лекарств из-за небольшого размера и высокой структурной стабильности (Yamamoto et al., 2007 [138]). Полимерные мицеллы классифицируются по типу межмолекулярных сил, движущих сердцевинный сегмент из водной среды. Три типа мицелл — это амфифильные мицеллы, образованные гидрофобными взаимодействиями, мицеллы полиионных комплексов, образованные электростатическими взаимодействиями, и мицеллы, возникающие в результате комплексообразования с ионами металлов (Gaucher et al., 2005 [42]). Гидрофобные блоки сополимеров образуют ядро мицелл. Многие полимеры, которые использовались в качестве гидрофобного сегмента в полимерных мицеллах, представляют собой полипропиленгликоль (PPO, Pluronics®) (Marin et al., 2002 [90]), поли (аспарагиновая кислота) с химически конъюгированным доксорубицином (PAsp (DOX) (Yokoyama et al., 1998 [140]), поли (ß-бензил-L-аспартат) (PBLA) (Kwon et al. , 1995 [79]) и полиэфиры, такие как поли (молочная кислота) (PLA) (Liggins and Burt, 2002 [82]), поли (ε-капролактон) (PCL) (Allen et al., 2000 [6]) и поли (триметиленкарбонат) (PTMC) (Zhang et al., 2006 [144]). Было обнаружено, что материалы, образующие ядро мицелл, влияют на стабильность, емкость загрузки лекарственного средства и профиль высвобождения лекарственного средства. Мицеллы образуются при концентрации блок-сополимера повышается выше определенного уровня, известного как критическая мицеллярная концентрация (Rijcken et al., 2007 [108]).
Синтез мицелл
Полимерные мицеллы получают многими методами. Выбор метода синтеза зависит от природы лекарственного средства и типа используемого полимера. Ниже приведены некоторые из наиболее часто используемых техник.
Метод экстракции растворителем
Метод экстракции растворителем используется для получения полимерных мицелл с высокой загрузкой лекарственного средства, хорошей стабильностью и пролонгированным высвобождением. В этом методе предварительно полученные полимеры растворяют в ацетоне и добавляют по каплям к бидистиллированной воде при перемешивании.Затем органический растворитель удаляется после продувки сухим азотом (Forrest et al., 2006 [36]).
Метод диализа
Полимеры, растворенные в смешивающихся с водой органических растворителях, подвергаются диализу против воды. Медленное удаление органического растворителя приводит к образованию мицелл (Gaucher et al., 2005 [42]).
Метод литья из раствора
Полимеры, растворенные в органическом растворителе, высушиваются до получения тонкой пленки. Затем тонкую пленку регидратируют нагретым водным растворителем с образованием мицелл (Gaucher et al., 2005 [42]).
Инкапсуляция различных типов лекарств
Многие лекарства были инкапсулированы в мицеллы для повышения их растворимости и терапевтической активности. Доксорубицин был инкапсулирован на мицеллах плюроника. Инкапсуляция доксорубицина в мицеллы снижает системное поглощение доксорубицина нормальными клетками в 2 раза по сравнению со свободным лекарственным средством (Marin et al., 2002 [90]). Паклитаксел был успешно инкапсулирован в мицеллы, состоящие из амфифильных блок-сополимеров, состоящих из метоксиполи (этиленгликоля) (MPEG) и поли (ε-капролактона) (PCL).Паклитаксел, инкапсулированный в амфифильные блок-сополимеры, проявляет большую цитотоксичность в отношении раковых клеток, что свидетельствует о значении мицелл (Park et al., 2005 [104]). Камптотецин был успешно включен в полимерные мицеллы, образованные из блок-сополимеров поли (этиленгликоль) -поли (бензиласпартат). Камптотецин, содержащийся в полимерных мицеллах, значительно ингибировал рост опухоли после однократной инъекции in vivo . Кроме того, камптотецин, загруженный в полимерные мицеллы, демонстрировал большее удерживание в крови и более высокое накопление в опухолях по сравнению со свободным камптотецином (Kawano et al., 2006 [64]). Оксалиплатин наносили на полимерные мицеллы поли (этиленгликоль) -бета-поли (глутаминовая кислота). Оксалиплатин, загруженный в полимерные мицеллы, проявлял повышенную противоопухолевую активность (Cabral et al., 2007 [21]). ß-лапахон представляет собой противораковое лекарственное средство растительного происхождения, цитотоксический эффект которого значительно усиливается НАД (Ф) Н: хиноноксидоредуктазой 1. ß-лапахон инкапсулирован на мицеллах PEG-PLA. ß-лапахон, инкапсулированный в мицеллы PEG-PLA, также показал медленное и продолжительное высвобождение (Blanco et al., 2007 [18]).
Амфотерицин B — мощный антибиотик, применяемый при грибковых инфекциях.Амфотерицин B был успешно загружен на полимерные мицеллы поли (этиленоксида) — блок, — поли ( N, -гексил-L-аспартамид). Амфотерицин, загруженный в полимерные мицеллы, демонстрировал замедленное высвобождение (Adams et al., 2003 [2]). Гельданамицин наносили на полимерные мицеллы поли (этиленгликоль) -b-поли (ε-капролактон) (PEG-b-PCL). Такая загрузка гелданамицина в полимерные мицеллы значительно улучшила растворимость в воде и эффективность (Forrest et al., 2006 [37]). Андриамицин успешно загружали на полимерные мицеллы поли (L-гистидин) поли (L-молочная кислота).Андриамицин показал pH-зависимое высвобождение из полимерных мицелл (Lee et al., 2003 [81]). Циклоспорин A является сильнодействующим иммунодепрессивным средством, используемым в первую очередь для снижения частоты отторжения трансплантата у реципиентов пересаженных органов. Циклоспорин А наносили на мицеллы метоксиполи (этиленоксид) -бета-поли (-капролактон). Полимерные мицеллы показали медленное и продолжительное высвобождение циклоспорина А (Aliabadi et al., 2005 [5]). Рапамицин — липофильный макролидный антибиотик с противогрибковым, иммунодепрессивным и противоопухолевым действием.Рапамицин загружали на полимерные мицеллы PEG-PCL. Рапамицин показал медленное и продолжительное высвобождение из мицелл PEG-PCL (Forrest et al., 2006 [36]).
Плазмидная ДНК, содержащая бактериальный ген LacZ, была включена в полимерные мицеллы поли (диметиламиноэтилметакрилата) (поли (бутилметакрилат)). Полимерные мицеллы, нагруженные ДНК, были способны трансфицировать клетки, не вызывая какой-либо токсичности (Funhoff et al., 2005 [39]).
Модификация поверхности мицелл
Поверхность мицелл модифицирована для увеличения времени циркуляции в крови.Гидрофильные полимеры — это наиболее часто используемые полимеры для модификации поверхности мицелл. Среди всего прочего, PEG является наиболее часто используемым гидрофильным полимером для увеличения стойкости в крови. ПЭГ образует щетку, похожую на корону, выступающую из поверхности полимерных мицелл (Gaucher et al., 2005 [42]). Гидрофильная корона PEG играет важную роль в предотвращении адсорбции и клиренса опсонина мононуклеарной фагоцитарной системой (Kwon, 2003 [78]). Скрытные свойства и период полураспада функционализированных ацетальдегидом мицелл ПЭГ-b-PDLLA были усилены за счет закрепления анионного пептидильного лиганда на поверхности мицелл, которые сообщали мицеллам отрицательный заряд (Yamamoto et al., 2001 [139]).
Направляющая способность может быть придана мицеллам путем присоединения лигандов, рецепторов или антител к гидрофильному сегменту, так что они взаимодействуют с мембранными рецепторами. Нацеленные мицеллы продемонстрировали большее клеточное поглощение и улучшенную эффективность, чем немодифицированные аналоги (Gaucher et al., 2005 [42]).
Загрузка лекарств и высвобождение из мицелл
Лекарства могут быть включены в полимерные мицеллы путем физического захвата или химической конъюгации (Gaucher et al., 2005 [42]). Также лекарство можно загрузить в ядро мицелл с помощью органических растворителей посредством эмульсии масло / вода, диализа и твердой дисперсии. На высвобождение лекарства из полимерных мицелл влияют многие факторы, такие как длина ядра, образующего сегмент полимера, сродство между лекарством и ядром и количество загруженного лекарства (Huh et al., 2005 [55]). Высвобождение физически адсорбированного лекарственного средства из полимерных мицелл регулируется диффузией лекарственного средства из мицеллярного ядра и коэффициентом распределения лекарственного средства по мицеллярному ядру и водной фазе.
Клеточный ответ мицелл
Мицеллы, конъюгированные с фолатом, показали большее поглощение клетками MCF-7 за счет взаимодействия со сверхэкспрессированными рецепторами фолиевой кислоты на поверхности раковых клеток (Park et al., 2005 [104]). В другом исследовании конъюгированные с фолатом поли (L-гистидин) -поли (L-молочная кислота) мицеллы были более эффективны в уничтожении раковых клеток (Lee et al., 2003 [81]). Полимерные мицеллы поли (диметиламиноэтилметакрилата) и поли (бутилметакрилата) были способны трансфицировать клетки COS-7 и OVCAR-3 с незначительной токсичностью (Funhoff et al., 2005 [39]). Полимерные мицеллы конъюгатов полиэтиленгликоль / фосфатидил-этаноламин (ПЭГ-ПЭ) накапливались в зоне инфаркта с эффективностью более чем в 8 раз по сравнению с неповрежденной частью сердечной мышцы за счет эффекта ЭПР (Лукьянов и др., 2004 [87] ]).
Углеродная нанотрубка (CNT)
Углеродная нанотрубка похожа на лист графита, свернутый в цилиндр, с характерной шестиугольной решеткой, составляющей лист. Углеродные нанотрубки (УНТ) представляют собой интересный материал из-за их диапазона размеров в наномасштабе и их широкого применения в нанотехнологиях и различных электронных устройствах (Frank et al., 1998 [38]; Kong et al., 1999 [72]), среды для хранения газа (Liu et al., 1999 [83]), нанопинцеты (Kim et al., 1999 [68]). Высокое соотношение сторон, высокая проводимость и внутренняя прочность связи углерод-углерод sp 2 (Ijima, 1991 [56]) придают композитам наивысшую прочность и проводимость для придания уникальных свойств (Wong et al., 1997 [133]; Ajayan et al., 2000 [4]). С момента открытия УНТ во всем мире было предпринято большое количество усилий для улучшения подготовки и изучения различных механизмов, используемых при их образовании.Существует два основных типа УНТ, которые могут иметь высокое структурное совершенство. Однослойные нанотрубки (ОСУНТ) состоят из одного листа графита, бесшовно свернутого в цилиндрическую трубку. В то время как многослойные нанотрубки (MWCNT) состоят из массива нанотрубок, одна из которых концентрически размещена внутри другой, как кольца ствола дерева (Qian et al., 2002 [106]).
Синтез УНТ
Сообщается о различных методах образования углеродных нанотрубок: дуговом разряде (Zeng et al., 1998 [142]), лазерной абляции (Ma et al., 2000 [88]), диспропорционирование окиси углерода (Herreyre et al., 1995 [54]), химическое осаждение из паровой фазы (CVD) (Benito et al., 1998 [17]), гидротермальный метод (Gogotsia et al., 2000 [ 43]).
Метод дугового разряда
Метод дугового разряда — самый старый метод синтеза УНТ. УНТ могут быть синтезированы с использованием аппарата дугового разряда, изготовленного из нержавеющей стали, который сначала вакуумируется, а затем заполняется жидкостью N 2 или атмосферой газообразного гелия. Стержень из чистого графита сделан анодом и легирован подходящим катализатором, таким как Fe, Co, Ni, или биметаллическим катализатором, таким как Y / Ni.Другой графитовый стержень сделан катодным. Дуга генерируется постоянным током 40–100 ампер с максимальным напряжением 50 В в атмосфере гелия при давлении 100–700 торр. В этих условиях эксперимента углеродный материал, сублимирующий на аноде, осаждается в виде твердой корки на катоде. После дугового разряда углеродистый материал собирается из катодных областей и характеризуется методами SEM, TEM и рамановской спектроскопии (Ijima, 1991 [56]).
ОУНТ и МСУНТ разного размера могут быть синтезированы путем изменения таких критических факторов, как используемый металлический катализатор, диапазон постоянного тока и подаваемого напряжения, а также давление газообразного или жидкого гелия N 2 и температурный градиент между электродами, используемыми в эксперименте. условия.
Метод лазерной абляции
В этом процессе поверхность углерода обычно облучается лазерным лучом при очень высокой температуре в инертной атмосфере в конкретном реакторе, и материал удаляется с поверхности. Углерод испаряется из-за тепла, выделяемого лазерным лучом. С помощью этого процесса можно синтезировать как SWCNT, так и MWCNT. Металлические катализаторы необходимо добавлять к графитовой мишени для синтеза ОСУНТ. Луч лазера направлен на углеродную мишень, содержащую 1.2% катализатор с 98,8% графитового композита при 1200 ° C в кварцевой трубчатой печи в инертной атмосфере аргона при высоком давлении ~ 500 Торр для получения ОСУНТ. Распределение диаметров ОСУНТ, полученных этим методом, варьируется примерно от 1,0 до 1,6 нм (Guo et al., 1995 [46]).
Количество, средняя длина и диаметр УНТ зависит от таких параметров, как длина волны лазера, состав используемого катализатора, температура, давление, тип используемого инертного газа. Процесс лазерной абляции намного лучше, чем метод дугового разряда.Чистота 90% УНТ с очень узким распределением диаметров может быть получена методом лазерной абляции.
Диспропорционирование CO
Реакции диспропорционирования — это реакции, в которых один элемент одновременно окисляется и восстанавливается. Реакция диспропорционирования CO, такая как 2 CO → C + CO 2 , дает только C и CO 2 в качестве продукта. Поскольку CO 2 является стабильным газом, а C используется как чистый источник для получения УНТ. В этом процессе ферроцен и пентакарбонил железа использовались под CO или N 2 в качестве газа-носителя при атмосферном давлении.Здесь CO реагирует с пентакарбонилом железа с образованием SWCNT при температуре от 1100 ° C до 1300 ° C с направлением потока вверх. Этот процесс называется HiPCO (реакция монооксида углерода под высоким давлением) (Moisala et al., 2006 [95]).
В другом исследовании был проанализирован синергетический эффект Мо и Со на характеристики катализатора для образования УНТ. Было обнаружено, что присутствие обоих металлов одновременно при низком соотношении Со: Мо на носителе из диоксида кремния является эффективным в качестве катализатора. Степень взаимодействия между Co и Mo зависит от соотношения Co: Mo в катализаторе (Resasco et al., 2002 [107]). Характеристика УНТ была проведена с помощью SEM, TEM, AFM и рамановской спектроскопии.
Химическое осаждение из газовой фазы (CVD)
Этот простой метод используется для производства УНТ с контролируемым направлением роста на подложке. Процесс включает прохождение смеси углеводородных газов (метана, этилена или ацетилена) через трубчатый реактор, в котором катализаторы, такие как Fe, Co и Ni, осаждаются на подложке (обычно диоксиде кремния) при температуре 600-1200 ° C. ° C при атмосферном давлении для разложения углеводородного материала (Kumar et al., 2010 [74]).
Кремнезем является идеальной подложкой для выращивания самоориентирующихся УНТ на больших поверхностях. УНТ, образующиеся в результате термического разложения, откладываются на подложке катализатора. На подложку из диоксида кремния с оксидным слоем наносили узор с помощью УФ-фотолитографии. Железо (Fe) в качестве катализатора откачивается электронным лучом на эту узорчатую подложку и обрабатывается ультразвуком в ацетоне в течение 30 мин. Затем подложку помещают на кварцевую трубку и герметизируют в печи CVD с кварцевой трубкой при температуре 700-800 ° C с использованием метана, ацетилена и водорода, а затем характеризуют (Turano and Ready, 2006 [126]).
Гидротермальный метод
Этот метод имеет много преимуществ по сравнению с методом CVD, поскольку он безопасен для окружающей среды, недорог и требует меньшего количества свободной энергии для различных равновесий. Образование гидротермальных УНТ происходит при относительно низкой температуре> 200 ° C и низком давлении 10-100 МПа. Недорогой полимерный полиэтилен (PE) используется в качестве источника углерода и помещается в деионизированную воду в Au капсуле. Количество используемой воды может варьироваться от 0 до 1,6 веса полиэтилена. В капсулу добавляют никелевый катализатор и нагревают в реакторе при 700-800 ° C в течение 2-24 часов при начальном давлении 60-80 МПа, а затем давление повышают до 100 МПа воды в течение достаточного периода времени, чтобы чтобы обеспечить полное термическое разложение ПЭ (Gogotsia and Libera, 2000 [43]).
Инкапсуляция различных типов лекарств на УНТ
Различные виды лекарств могут быть инкапсулированы в полую структуру или внутренние полости УНТ для повышения их эффективности. Фолиевая кислота (FA) и PEG непосредственно адсорбировались на поверхности CNT, чтобы создать водорастворимую и нацеленную на раковые клетки систему доставки лекарств. Лекарственное средство доксорубицин (DOX) наносили на поверхность УНТ PEG-FA с эффективностью загрузки 149,3 ± 4,1%. Система доставки лекарственного средства высвобождает DOX при пониженном значении pH, особенно для среды раковых клеток и для лизосом / эндосом.Высвобожденный DOX остановит транскрипцию, что приведет к гибели клеток (Niu et al., 2013 [101]). Паклитаксел (РТХ) конъюгировали с ПЭГилированными SWCNT, и при конъюгации их уровень токсичности по отношению к опухолевым клеткам был почти таким же, как у таксола в условиях in vivo . Это увеличило время циркуляции PTX в крови, что привело к увеличению поглощения препарата опухолевыми клетками (Liu et al., 2008 [85]).
Противоопухолевый агент HCPT был ковалентно конъюгирован с MWNT с использованием диаминотриэтиленгликоля.MWNT-HCPT, конъюгированный с 16% -ной загрузкой лекарственного средства, превосходил по своей противоопухолевой активности из-за длительного времени циркуляции крови по сравнению с клиническими препаратами HCPT. Профиль быстрого высвобождения лекарственного средства HCPT наблюдался при pH = 5,0, чем при pH = 7,4, в течение периода мониторинга продолжительностью 128 часов (Wu et al., 2009 [134]). Карбоплатин, терапевтическое средство для лечения рака, вводили в открытую УНТ влажным химическим методом. Эффект этого препарата на пролиферацию клеток и цитотоксичность клеток был протестирован на линии клеток рака мочевого пузыря человека EJ28.Испытания подтвердили противораковое действие УНТ, заполненных цисплатином (Hampel et al., 2008 [51]).
Поверхностные модификации CNT
CNT представляют собой пространственно объемные, π-конъюгированные лиганды и электронодефицитные алкены. ОУНТ могут вступать в реакцию не только на концах и дефектных участках, но и вдоль боковых стенок. Уникальные механические и электронные свойства могут быть определенным образом изменены с помощью контролируемой химической функционализации (Banerjee et al., 2005 [15]).УНТ, синтезированные с использованием всех вышеперечисленных методов, обычно дают образец, который представляет собой смесь УНТ различного диаметра и хиральности и часто загрязнен металлическими и аморфными примесями. Химическая обработка УНТ необходима для их разделения по диаметру и реакционной способности.
Межфазное взаимодействие MWCNTs может быть улучшено с помощью матрицы путем присоединения эпоксидной функциональной группы к нанотрубкам (Gojny et al., 2003 [44]). Чтобы улучшить химическую совместимость MWCNT со специфическими полимерами для применения в композитах с полимерной матрицей на основе нанотрубок, функционализированные MWCNT были силанизированы с использованием связующего агента, 3-аминопропилтриэтоксисилана (3-APTES) (Kathi and Rhee, 2008 [63]).Был разработан универсальный метод селективного прикрепления наночастиц золота к УНТ с различными модификациями нанотрубок для расширения возможностей применения для создания электрических, оптических и сенсорных устройств (Jiang et al., 2003 [60]).
Загрузка и высвобождение лекарства
Есть два способа загрузки лекарства в УНТ. В одном случае молекула лекарственного средства включается в наночастицу во время формирования наноформуляции. В противном случае лекарство загружается методом адсорбции после синтеза наночастиц (Singh and Lillard, 2009 [118]).Небольшие молекулы могут быть загружены методом ковалентной конъюгации, в то время как молекулы других ароматических лекарств могут быть загружены на УНТ с помощью нековалентной супрамолекулярной химии через π-π-стэкинг (Liu et al., 2009 [86]). Высвобождение лекарства из УНТ можно контролировать, варьируя значение pH и температуру.
Клеточный ответ
Природа функциональных групп, прикрепленных к поверхности УНТ, играет важную роль в определении механизма взаимодействия с клеточным аппаратом.Механизм захвата CNT клетками также может варьироваться в зависимости от размера CNT, включая эндоцитоз или пассивную диффузию. In vitro реакция фибробластов (Zhou et al., 2010 [145]) продемонстрировала, что клетки MC3T3-E1 сильно реагируют на нанотопографию поверхности бионанокомпозитных пленок PVA / галлуазитовых нанотрубок (HNTs). Прозрачные бионанокомпозитные пленки способствовали прикреплению и росту фибробластов до менее 7,5 мас.% Включенных HNT. Механизм клеточного поглощения клетками HeLa заключается в том, что DOX / PEG-FA / SWCNT сначала прикрепляются к клеточной мембране клеток HeLa посредством нацеливания на фолиевую кислоту (FA) и проникают в лизосомы или эндосомы посредством клатрин-опосредованного эндоцитоза.Затем DOX высвобождается в кислой среде лизосом и мигрирует в ядро, чтобы ингибировать транскрипцию путем связывания с ДНК и индуцирует гибель клеток (Niu et al., 2013 [101]).
Дендример
Дендример представляет собой макромолекулу, которая представляет собой сильно разветвленные, монодисперсные, симметричные и сферические трехмерные полимерные молекулы с четко определенной молекулярной массой. Химия дендримеров была впервые открыта Buhleier et al. (1978 [20]). В 1985 году Томалия с соавторами [125] синтезировали первое семейство дендримеров.Группа Ньюкома независимо сообщила о синтезе подобных макромолекул и назвала их арборолами (Newkome et al., 1985 [100]). Термин дендример произошел от греческих слов dendron (дерево) и meros (часть). Другие синонимы дендримеров — арборолы и каскады. Но дендример — наиболее приемлемый термин во всем мире. Дендримеры обеспечивают высокую степень универсальности и функциональности поверхности. Функциональность этих наноструктурных дендримеров может быть даже улучшена путем инкапсуляции или конъюгации биоактивных агентов на поверхности дендримеров (Tomalia and Frechet, 2002 [125]).Дендример состоит из трех архитектурных компонентов: ядра, ответвлений и поверхностных фрагментов. Благодаря своему поливалентному и монодисперсному характеру дендримеры вызвали широкий интерес в области химии и биологии, особенно в таких приложениях, как доставка лекарств, генная терапия и химиотерапия.
Синтез дендримеров
Синтез дендримеров требует выбора подходящего инициатора, который может быть преобразован в ядро. Ядро реагирует с рядом молекул в итеративной последовательности реакций с образованием нового поколения высокомолекулярных и разветвленных дендримеров, имеющих определенную молекулярную поверхность.Дендримеры производятся в итеративной последовательности шагов реакции, где добавление каждой итерации дает более высокое поколение дендримеров (Tomalia and Frechet, 2002 [125]). Метод синтеза, используемый для получения дендримеров, позволяет практически полностью контролировать критические параметры молекулярной конструкции, такие как размер, форма, химический состав поверхности / внутреннего пространства, гибкость и топология. Дендримеры могут быть синтезированы с использованием следующих трех различных подходов (Crespo et al., 2005 [31]).
Дивергентный подход
В этом методе дендример растет от многофункциональной центральной молекулы к периферии.В результате этого роста каждая новая итерационная реакция характеризуется генерацией экспоненциально увеличивающегося числа функциональных групп на периферии и удвоением молекулярной массы по сравнению с предыдущим слоем (Buhleier et al., 1978 [20]). Стадии реакции можно повторять для увеличения размера дендримеров по мере необходимости. Многие проблемы возникают из-за побочных реакций и неполных реакций концевых групп, которые приводят к структурным дефектам. Для предотвращения побочных реакций и завершения реакций требуется большое количество реагентов.Поэтому существует сложность очистки конечного продукта, полученного этим методом (Klajnert and Bryszewska, 2001 [69]).
Конвергентный подход
Конвергентный метод формирует дендример снаружи внутрь, как раз противоположный таковому при дивергентном подходе. Формирование дендримеров начинается с периферийного конца и продвигается к сердцевине. Он включает синтез дендримерных фрагментов с последующим их добавлением к сердцевине. С помощью этого метода легко изменить основную группу, но сложно изменить конечную группу.Конвергентный метод имеет некоторые преимущества перед дивергентным методом, поскольку он не позволяет формировать большое количество дендримеров из-за проблем, связанных со стерическими препятствиями между реакциями концевых групп с молекулами ядра (Hawker and Frechet, 1990 [53]). Относительно легче очистить конечный продукт, и дефекты в конечной структуре сведены к минимуму (Crespo et al., 2005 [31]; Klajnert et al., 2001 [69]).
Двухэтапный конвергентный подход
Синтез дендримеров с использованием дивергентного или конвергентного подхода требует значительного количества шагов и занимает много времени.Для решения этих проблем наилучшим подходом к синтезу дендримеров является двухстадийный конвергентный подход. Двухэтапный конвергентный подход представляет собой сочетание дивергентного и конвергентного подходов (Takanashi and Yamamoto, 2007 [123]). В этом методе строительные блоки синтезируются дивергентным методом с последующей сборкой конвергентных дендримеров. Получение дендримеров более высокого поколения не является утомительным, поскольку сокращает количество стадий синтеза и очистки конечного продукта.Более того, легко модифицировать строительные блоки во время синтеза дивергентным методом и сборкой дендримеров с другими строительными блоками для увеличения разнообразия (Crespo et al., 2005 [31]).
Инкапсуляция различных лекарств на дендримерах
Молекулы лекарств могут быть ковалентно присоединены к периферии дендримеров с образованием пролекарств дендримеров. Второй метод заключается в том, что молекула лекарства координируется с внешними функциональными группами с помощью ионных взаимодействий. Третий метод описывает, что дендример действует как мономолекулярная мицелла, содержащая гидрофобное ядро и полярную поверхность, путем инкапсуляции молекулы лекарства посредством образования взаимодействия дендример-лекарство (хозяин-гость).Инкапсулирующая способность дендримеров увеличивается с увеличением образования дендритов и с увеличением размера и молекулярной массы присоединенных функциональных групп (Crampton and Simanek, 2007 [30]).
Доксорубицин (DOX) конъюгировали с дендримерами PAMAM через амид или гидразон (гид). Стратегии фотохимической интернализации (PCI) «свет до» и «свет после» использовали для улучшения цитотоксичности DOX в отношении клеток Ca9-22. Было замечено, что обработка PCI «свет после» увеличивала высвобождение DOX из конъюгата дендример DOX-hyd-PAMAM по сравнению с обработкой PCI «светом до», которая приводила к накоплению DOX в ядре и вызывала большую гибель клеток.Но обе стратегии PCI не смогли улучшить цитотоксический эффект дендримера DOX-амид-PAMAM (Lai et al., 2007 [80]). Паклитаксел инкапсулировали в полимерный раствор поли (OEGMA), пятиконечного звездчатого поли (OEGMA) и дендримеров полиглицерина (dendriPG). Повышенная растворимость паклитаксела была обнаружена в порядке возрастания DendriPG, пятиконечного звездчатого поли (OMEGA) и поли (OMEGA). Исследование высвобождения паклитаксела показало, что весь паклитаксел высвобождается из дендримерных растворов через 96 часов. Понимание механизма растворимости при использовании полимеров поможет разработать лучшую систему доставки для плохо растворимых лекарств (Ooya et al., 2003 [102]). Противоопухолевые препараты 10-гидрокси-камптотецин (HCPT) и 7-бутил-10-аминокамптотецин (BACPT) инкапсулировали в дендримеры сложного полиэфира методом испарения растворителя. После инкапсуляции наблюдали 20-кратное увеличение растворимости 10-HCPT в воде. Метод инкапсуляции дендримеров повысил эффективность лекарственного средства и клеточно-специфическое поглощение камптотецина линиями клеток рака толстой кишки человека HT29 (Morgan et al., 2006 [96]).
Флурбипрофен (ФБ) — производное фенилпропионовой кислоты, обладающее анальгетической и противовоспалительной активностью.Препарат широко применяется при лечении ревматоидного артрита. Сообщалось об использовании дендримеров PAMAM для инкапсуляции и контролируемого высвобождения FB (Asthana et al., 2005 [11]). Исследования in vivo показали, что сначала лекарство высвобождается быстро, а затем постепенно высвобождается сравнительно медленно. Дендримеры смогли локализовать лекарство в месте воспаления, поэтому лекарство показало свои лучшие фармакологические действия. Дендримеры PAMAM также использовались в качестве носителей для доставки лекарств для увеличения трансдермального проникновения идометацина, поскольку лекарство является гидрофобным и плохо растворяется в водной среде.Дендримеры действуют как носители для транспортировки молекул лекарства в коже в солюбилизированной форме (Chauhan et al., 2003 [25]).
Молекула лекарственного средства ибупрофен была инкапсулирована в дендримеры PAMAM, полученные с функциональностью 3 и 4 –NH 2 методом испарения растворителя. Комплекс дендример-ибупрофен быстро проник в клетки эпителиальной карциномы легких A549. Было обнаружено, что чистый ибупрофен попадает в клетку через 3 часа, но комплексы дендример-ибупрофен вводятся в клетку через 1 час.Итак, эти результаты показывают, что дендримеры могут эффективно переносить лекарство внутри клетки (Kolhe et al., 2003 [71]).
Поверхностные модификации дендримеров
Поверхность дендримеров полиамидоаминов с концевыми аминогруппами (ПАМАМ) была модифицирована несколькими способами, чтобы снизить токсичность амино-концевых групп, повысить биосовместимость и растворимость дендримеров в воде, чтобы активировать действие лекарства. эффективность переноса в ткань-мишень (Kim et al., 2008 [68]). Дендримеры, конъюгированные с лигандом, служат для многих биомедицинских применений, таких как доставка лекарств, противовирусные агенты, разработка различных искусственных белков.Конъюгаты пептид и сахарид-дендример были приготовлены для повышения эффективности (Chabre and Roy, 2008 [23]; Sebestik et al., 2011 [113]). Поверхность дендримеров PAMAM была модифицирована полиэтиленгликолем, L-аргинином (Choi et al., 2004 [27]). Jevprasesphant et al. (2003 [59]) доказали, что дендримеры PAMAM, модифицированные лауроильными фрагментами, демонстрируют пониженную цитотоксичность и повышенную проницаемость при взаимодействии с клетками Caco-2 по сравнению с немодифицированными дендримерами.
Загрузка и высвобождение лекарств
Дендримеры используются в качестве средств доставки лекарств из-за относительно более высокой химической и биологической стабильности, эффективности, чистоты и длительного срока хранения.Молекулы лекарства могут быть загружены внутрь дендримеров путем физического захвата или химического конъюгирования. Молекула лекарства высвобождается внутри клеток по двум разным механизмам. Один из методов включает разрыв in vivo и ковалентной связи между лекарственным средством и дендримером, что может быть возможным в присутствии подходящей среды или в присутствии ферментов. Второй способ высвобождения лекарства зависит от изменений pH и температуры внутри клеток (Mishra, 2011 [93]).
Клеточный ответ
Увеличение клеточного поглощения лекарств зависит от плотности заряда и гибкости дендримеров (Morgan et al., 2006 [96]). Дендримеры полипропиленимина G-4 увеличивали клеточное поглощение 31 нуклеотидного триплекс-образующего олигонуклеотида (ODN) в 14 раз в клетках рака груди MDA-MB-231 для доставки в клеточные линии рака простаты, груди и яичников по сравнению с контрольным ODN. поглощение (Santhakumaran et al., 2004 [111]). Дендримеры увеличивают доступность и антипролиферативную активность интактных ODN в клетках до 48 часов и более. SWCNT, покрытые дендримерами PAMAM, снижали цитотоксичность и улучшали клеточное поглощение линиями раковых клеток MCF-7.Покрытые дендримером ОСУНТ проникали в цитоплазму клетки посредством эндоцитоза, но ОСУНТ без покрытия не могли проходить через клеточные мембраны (Pan et al., 2007 [103]). Дендримеры, инкапсулированные 10-гидроксикамптотецином, увеличивали клеточное поглощение в 16 раз, а также увеличивает время удерживания соединения в линиях раковых клеток (Morgan et al., 2006 [96]).
Магнитные наночастицы (MNP)
Магнитные наночастицы (MNP) представляют большой интерес для ученых в последние несколько десятилетий из-за их отличных магнитных свойств для использования в различных новых приложениях, начиная от хранения данных высокой плотности до биомедицинских приложений.Магнитная поверхность МНЧ позволяет им прикрепляться к функциональным молекулам, которые затем обеспечивают магнитное поведение мишени (Ahn et al., 2004 [3]). Это помогает манипулировать и транспортировать молекулы к желаемому органу-мишени, контролируя создаваемое магнитное поле. Три функциональные части носителя MNP — это магнитный сердечник, поверхностное покрытие и функциональное внешнее покрытие (Vatta et al., 2006 [127]). Магнитопровод состоит из надмагнитной молекулы, состав которой зависит от области применения.Поверхностное покрытие требуется для обеспечения стерического отталкивания, повышения стабильности и предотвращения агломерации частиц (Charles et al., 1980 [24]). Функциональное внешнее покрытие может содержать любой лиганд или биологически активную молекулу для различных биомедицинских применений (Hafeli, 2004 [50]).
Синтез МНЧ
Существуют различные методы синтеза МНЧ, которые включают соосаждение, термическое разложение, микроэмульсию, гидродермальный синтез, сонохимический и золь-гель метод.Наиболее важным методом синтеза супрамагнитных НЧ является соосаждение. Основная проблема для синтеза монодисперсных МНЧ подходящего размера — выбрать подходящие экспериментальные условия.
Метод соосаждения
Метод соосаждения обычно касается осаждения веществ, обычно растворимых в применяемых условиях. Это простой и легкий метод синтеза оксидов железа (Fe 3 O 4 или γ-Fe 2 O 3 ) из водных растворов солей Fe 2+ / Fe 3+ . добавлением основания при комнатной температуре или при повышенной температуре в инертных условиях.Massart (1981 [91]) впервые выполнил контролируемое получение частиц суперпарамагнитного оксида железа с использованием щелочного осаждения FeCl 3 и FeCl 2 . Размер, форма и состав МНЧ зависят от типа используемых солей (например, хлориды, сульфаты, нитраты), соотношения Fe 2+ / Fe 3+ , температуры реакции, pH и ионной силы. средств массовой информации (Babes et al., 1999 [13]). Основное преимущество этого процесса состоит в том, что можно синтезировать большое количество НЧ.Однако контроль распределения частиц по размерам ограничен, потому что только кинетические факторы могут контролировать рост кристалла.
Метод термического разложения
МНЧ монодисперсного типа и небольшого размера могут быть синтезированы термическим разложением металлорганических прекурсоров в высококипящих растворителях, содержащих стабилизирующие поверхностно-активные вещества. Соотношения предшественников, поверхностно-активных веществ, растворителей, температуры реакции, время реакции являются важными параметрами для контроля размера и формы синтезированных МНЧ.Формирование нанокристаллов оксида железа с помощью галогена было выполнено и показало, что ионы Cl — и Br — работают на стабилизацию 100 граней нанокристаллов оксида железа со спинной структурой (Xu et al., 2010 [136]).
В литературе описан общий и очень простой подход к синтезу нанокристаллов магнитного оксида железа с контролируемым размером и морфологией. Реакционная система основана на термическом разложении солей металлических жирных кислот, таких как декановая кислота, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, олеиновая кислота, стеариновая кислота, и углеводородный растворитель, такой как октадецен (ODE), н-эйкозан, тетракозан или смесь ODE и тетракозана.С использованием этого подхода были синтезированы монодисперсные нанокристаллы Fe 3 O 4 размером 3-50 нм. Этот метод также может быть использован для синтеза металлических НЧ (Jana et al., 2004 [58]).
Микроэмульсия
Микроэмульсии — это прозрачные, термодинамически стабильные, изотропные жидкие смеси масла, воды и поверхностно-активного вещества, которые часто используются в сочетании с дополнительным поверхностно-активным веществом. Молекула поверхностно-активного вещества снижает межфазное натяжение между водой и маслом, что приводит к образованию прозрачного раствора.Есть три основных типа микроэмульсий; прямое (масло, диспергированное в воде, мас. / мас.), обратное (вода, диспергированное в масле, мас. / мас.) и бинепрерывное. Метод микроэмульсии вода-в-масле (без воды) широко используется для синтеза МНЧ одинакового размера (Liu et al., 2000 [84]). МНЧ оксида железа синтезировали с использованием додецилбензолсульфоната натрия (NaDBS) с образованием обратных мицелл вода-в-толуоле. Средний размер частиц монокристаллических МНЧ находится в диапазоне от 4 до 15 нм.
Santra et al.(2001 [112]) описали метод микроэмульсии вода в масле для синтеза наночастиц оксида железа без покрытия и с покрытием из диоксида кремния. Для приготовления микроэмульсий использовали Triton X-100, Igepal CO-520 и Brij-97 в качестве неионных поверхностно-активных веществ и NH 4 OH, NaOH в качестве основания. Изучено их влияние на размер частиц, кристалличность и магнитные свойства. Микроэмульсии могут быть использованы для синтеза монодисперсных НЧ различной морфологии. Основными недостатками этого метода являются необходимость в большом количестве растворителя, низкий выход продукта, сложность масштабирования и неблагоприятное влияние остаточных поверхностно-активных веществ на свойства МНЧ (Faraji et al., 2010 [34]; Hasany et al., 2012 [52]).
Гидротермальный синтез
Гидротермальный технологический метод синтеза МНЧ также называется сольвотермическим методом. Он включает водные реакции, обычно проводимые с использованием автоклавов при высоком давлении более 2000 фунтов на квадратный дюйм и при высокой температуре более 200 ° C. В этом процессе условия реакции материала-предшественника, растворителя, температуры, pH и времени имеют важное влияние на продукт и фазовую чистоту наночастиц (Chen and Xu, 1998 [26]).Существует два основных пути образования ферритов в гидротермальных условиях: гидролиз и окисление, а второй — нейтрализация смешанных гидроксидов металлов.
Также сообщалось о синтезе наночастиц феррита никеля с использованием этиленгликоля в качестве растворителя и NaAc в качестве электростатического стабилизатора. Размер НЧ легко регулировался от 6 до 170 нм, регулируя экспериментальные параметры, такие как продолжительность реакции, начальная концентрация реагентов, количество защитных реагентов и тип используемых ацетатов.Главный недостаток обычного гидротермального метода — медленная кинетика реакции при любой заданной температуре. Однако эту проблему можно решить с помощью микроволнового нагрева (Wang et al., 2009 [129]).
Сонохимический метод
Сонохимический метод используется для создания новых материалов с необычными свойствами. Фактически, физико-химические эффекты очень высокой температуры, вызванной горячим пятном из-за быстрого схлопывания акустически созданных полостей, позволяют превращать соли двухвалентного железа в MNP.С помощью сонохимического метода синтезированы суперпарамагнитные НЧ оксида железа (СПИО) высокой намагниченности и кристалличности. Покрытые SPIO диспергировали в хитозане. Гидродинамический диаметр SPIO с покрытием в растворе хитозана оказался равным 65 нм (Kim et al., 2005 [65]).
Также наноразмерные порошки аморфных сплавов Co 20 Ni 80 и Co 50 Ni 50 были приготовлены сонохимическим разложением растворов летучих органических предшественников Co (NO) (CO) 3 и Ni. (CO) 4 в декалине, под давлением аргона от 100 до 150 кПа при 273 К.Магнитные измерения показали, что полученные частицы аморфного сплава CoNi были суперпарамагнитными (Shafi et al., 1998 [114]).
Золь-гель метод
Золь-гель процесс основан на гидроксилировании и конденсации молекулярных предшественников, таких как алкоксиды металлов, в растворе, образуя «золь» нанометровых частиц. Затем «золь» сушат или называют «гелеобразным» путем удаления растворителя или химической реакции с образованием трехмерной сетки оксида металла (Ismail, 2005 [57]). Важнейшие факторы, такие как растворитель, температура, природа и концентрация используемых предшественников солей, катализатор, добавки, pH и перемешивание, влияют на кинетику, реакции роста, гидролиз, реакции конденсации, а также структуру и свойства геля (Hasany et al., 2012 [52]).
Золь-гель метод был использован для получения серии нанокомпозитов Fe 2 O 3 -SiO 2 (9-33% Fe 2 O 3 по массе) и подвергшихся термообработке в температурный диапазон 300 ° C-900 ° C. Синтезированные нанокомпозиты были дополнительно охарактеризованы с помощью XRD, TEM, EPR и измерений магнитной восприимчивости (Cannas et al., 1998 [22]). Перовскит высокой чистоты La 2/3 Ca 1/3 MnO 3 также был получен с помощью простого золь-гель процесса путем растворения соответствующих неорганических солей в смеси этанола и уксусной кислоты без использования каких-либо комплексообразователей ( е.например, полиол или полигидроксикислота и т. д.), который в других случаях по существу используется в способах получения полимерных предшественников (Mathur and Shen, 2002 [92]).
Инкапсуляция различных лекарств внутри MNP
Различные виды лекарств были инкапсулированы в MNP для адресной доставки. Молекулы терапевтических лекарств либо прикрепляются к поверхности MNPs, либо инкапсулируются в нанокомпозитную смесь полимера и MNPs (Mody et al., 2013 [94]). Наличие различных полимерных или металлических / неметаллических покрытий на поверхности МНЧ обеспечивает лучшую возможность прикрепления различных лекарств для адресной доставки.
В рамках этой категории DOX доставлялся в целевые участки опухоли с использованием MNP дендримеров PAMAM G 2 , G 3 , G 4 и G 7 PAMAM (DcMNP). Максимальная концентрация нагрузки лекарственного средства составляла 400 мкг / мл. Интересно, что G 4 DcMNPs оказались наиболее эффективными системами доставки лекарств (Rouhollah et al., 2013 [110]). Противоопухолевый агент, паклитаксел, был ковалентно конъюгирован с магнитными наночастицами, покрытыми диоксидом кремния (TXL-SiMNP). Для проверки противоопухолевой активности на клетках аденокарциномы молочной железы человека (MDA-MB-468 тройной отрицательный) в течение 5 дней проводили оценку in vitro и разработанных SiMNP-TXL и SiMNP в качестве контрольных составов в различных концентрациях.Составы SiMNP, нагруженные TXL, оказались цитотоксичными в отношении опухолевых клеток в зависимости от концентрации (Auzenne et al., 2013 [12]).
5-ФУ инкапсулировали в НЧ магнетита / PLGA для магнитно-контролируемой доставки 5-ФУ к раковым клеткам. Эффективность инкапсуляции МНЧ составляла 60-80%. Профили высвобождения in vitro 5-ФУ указывают на начальное быстрое высвобождение с последующим 7-дневным лагом. Это означает потенциальную жизнеспособность наноматериалов магнетит / PLGA для эффективной доставки лекарств (Ashjari et al., 2012 [9]). Куркумин — это основной полифенольный пигмент, содержащийся в корне куркумы, обладающий противоопухолевой и антиоксидантной активностью. Однако эффективность и биодоступность куркумина как такового очень низкая. Таким образом, куркумин был инкапсулирован в полимерный МНЧ, который был синтезирован путем сшивания полимеров β-циклодекстрина с эпихлоргидрином и магнетитом в качестве магнитного материала. Высвобождение in vitro МНЧ, нагруженных куркумином, показало начальное высвобождение в течение первых 24 часов с последующим медленным высвобождением до 96 часов (Silambarasi et al., 2012 [117]).
Метотрексат (МТХ), противораковое лекарственное средство, ковалентно связывается с супрамагнитными НЧ оксида железа для направленной доставки лекарственного средства в раковые клетки, имеющие сверхэкспрессированные рецепторы фолиевой кислоты на поверхности (Kohler et al., 2005 [70]). Обработка разработанного нанокомпозита МТХ на клетках MCF-7 и HeLa показала их интернализацию на высоком уровне в лизосомы. Здесь, в лизосоме, метотрексат высвобождается при низком pH в результате ферментативного расщепления пептидной связи. Эти исследования документально подтвердили, что МНЧ могут использоваться в качестве интеллектуальных носителей для контролируемой и адресной доставки лекарств
Модификация поверхности МНЧ
МНЧ очень чувствительны к реакциям агломерации и окисления из-за их большой площади поверхности и сильного магнитного дипольного взаимодействия.Часто желательно защитить поверхность MNP с помощью стабилизаторов, чтобы уменьшить реакции окисления и агрегацию из-за магнитных и электрических взаимодействий. Кроме того, модификации поверхности также повышают стабильность МНЧ, делая их более биосовместимыми. Это позволяет осуществлять дальнейшую функционализацию поверхности наночастиц для обеспечения дополнительных функций магнитного сердечника (Williams and Corr, 2013 [132]). Следовательно, поверхность МНЧ может быть легко функционализирована с помощью покрытий из полимеров, кремнезема, углерода и металла.
Было показано, что стабильность в биологических средах повышается за счет покрытия поверхности MNP гуммиарабиком (GA). НЧ, обработанные GA, образовывали более мелкие агломераты по сравнению с необработанными образцами в течение 30 часов (Williams et al., 2006 [131]). Поверхность МНЧ, покрытая диоксидом кремния, была модифицирована (аминопропил) -триэтоксисиланом (APTS) для повышения их потенциала в исследованиях и диагностических приложениях (Bruce and Sen, 2005 [19]). Поверхность супрамагнитных НЧ была модифицирована ПЭГ для увеличения их биосовместимости и клеточного поглощения.Такое влияние ПЭГилированных НЧ было изучено на клетках фибробластов человека (Gupta, Curtis, 2004 [49]).
Загрузка и высвобождение лекарства
MNP служат в качестве эффективной системы доставки лекарства и, следовательно, предлагают гибкую загрузку лекарства и длительное терапевтическое высвобождение лекарства под влиянием внешнего магнитного поля. Молекула лекарства может быть загружена в MNP различными способами, включая ковалентное связывание, электростатические взаимодействия, адсорбцию или инкапсуляцию в порах магнитного носителя (Mody et al., 2013 [94]). Инкапсуляция лекарства внутри MNP подтверждается УФ-видимой спектроскопией, FTIR и HPLC. Магнитные частицы, заполненные лекарством, достигают целевого участка с помощью активных и пассивных механизмов. Активный механизм основан на прикреплении MNP к лигандам и привлечении этих конъюгатов к белкам сайта-мишени. Пассивный механизм основан на эффекте повышения проницаемости (EPR) внутри кровеносных сосудов и клеток-мишеней (Arruebo et al., 2007 [8]).
Клеточный ответ
MNP используются в качестве системы доставки лекарств для доставки к тканям / клеткам.Клеточный ответ определенного типа клеток на лекарство возможен путем покрытия поверхности МНЧ подходящими лигандами, которые могут связываться с рецепторами органов-мишеней (Kim et al., 2006 [66]). Конъюгированные с биотином покрытые липидом МНЧ были функционализированы на поверхности с помощью стрептавидина, флуоресцеина изотиоцианата (FITC), было показано поглощение клетками HeLa и обнаружено, что они локализованы в лизосомном компартменте за счет рецептор-опосредованного эндоцитоза (Becker et al., 2007 [16]). Поглощение покрытых диоксидом кремния МНЧ, содержащих изотиоцианат родамина B (RITC), клетками рака легкого человека A549 зависит от температуры и происходит посредством энергозависимого эндоцитоза эндосомами.Метаболические ингибиторы и низкая температура в 4 градуса ингибировали клеточное поглощение МНЧ (Kim et al., 2006 [66]). Также были исследованы клеточное поглощение и цитотоксичность МНЧ, покрытых пуллуланом, по сравнению с МНЧ без покрытия. Покрытые МНЧ снижают цитотоксичность фибробластных клеток человека и усиливают клеточное поглощение разными путями, отличными от непокрытых МНЧ (Gupta and Gupta, 2005 [48]). Родригес и др. (2013 [109]) нанесли карбоксиметил инулин на поверхность НЧ оксида железа и протестировали их цитотоксичность по отношению к различным линиям раковых клеток.Они наблюдали удовлетворительное поглощение покрытых оболочкой МНЧ клеточными линиями Caco-2 в зависимости от времени и концентрации.
Выводы
NC являются важными кандидатами для доставки терапевтических агентов, важных для фармацевтической промышленности. У них есть преимущества перед обычными перевозчиками. Они могут улучшить эффективность и биодоступность многих терапевтических агентов, которые иначе трудно доставить. NC увеличивают период полувыведения и стойкость многих терапевтических агентов, тем самым увеличивая их терапевтический индекс.НК с модифицированной поверхностью с гидрофильными полимерами или лигандами увеличивают нацеленность и специфичность многих терапевтических агентов. Модификация поверхности NC открывает путь для увеличения клеточного поглощения и связывания. Связывание небольших молекул на поверхности NC также увеличивает клеточное поглощение и взаимодействие. Благодаря грамотной разработке NC многие терапевтические агенты войдут в клинические испытания. Текущие исследования сосредоточены на инкапсуляции и целевой доставке терапевтических агентов. Но необходимы более обширные исследования, чтобы установить клеточные взаимодействия и судьбу нагруженных терапевтическим агентом NC.
Благодарности
Авторы выражают признательность директору CSIR-IHBT за его ценные советы и поддержку. RS благодарит UGC за предоставление стипендии в форме JRF. RS также выражает признательность AcSIR. AG благодарит проект CSIR BSC-112 за финансовую помощь в виде проектной стипендии. Мы искренне признательны за финансовую помощь в виде гранта для проекта BSC-112 от Совета по научным и промышленным исследованиям (CSIR) правительства Индии.
Ссылки
1. Abraham SA, McKenzie C, Masin D, Ng R, Harasym TO, Mayer LD, et al.Исследование in vitro и in vivo доксорубицина и винкристина, коинкапсулированных в липосомах, с использованием комплексообразования с ионами переходных металлов и нагрузки градиентом pH. Clin Cancer Res. 2004. 10: 728–738. [PubMed] [Google Scholar] 2. Адамс М.Л., Квон Г.С. Относительное состояние агрегации и гемолитическая активность амфотерицина В, инкапсулированного мицеллами конъюгата поли (этиленоксид) -блок — поли (N-гексил-L-аспартамид) -ацил: влияние длины ацильной цепи. J Control Release. 2003. 87: 23–32. [PubMed] [Google Scholar] 3.Ан CH, Choi JW, Cho HJ. Наномагнетики для биомедицинских приложений. В: Nalwa HS, редактор. Энциклопедия нанонауки и нанотехнологий. Vol. 6. Калифорния, Ранчо Стивенсона: американские научные издатели; С. 815–821. [Google Scholar] 4. Аджаян П.М., Шадлер Л.С., Джаннарис С., Рубио А. Одностенные композиты из углеродных нанотрубок и полимеров: прочность и слабость. Adv Mater. 2000; 12: 750–3. [Google Scholar] 5. Алиабади Х.М., Махмуд А., Шарифабади А.Д., Лавасанифар А. Мицеллы метоксиполи (этиленоксид) -b-поли (q-капролактона) в качестве носителей для солюбилизации и контролируемой доставки циклоспорина А.J Control Release. 2005; 104: 301–11. [PubMed] [Google Scholar] 6. Аллен С., Хан Дж., Ю. Ю., Мейсингер Д., Айзенберг А. Мицеллы сополимера поликапролактон-бета-поли (этиленоксид) в качестве носителя для доставки дигидротестостерона. J Control Release. 2000. 63: 275–86. [PubMed] [Google Scholar] 7. Алонсо MJ. Наномедицины для преодоления биологических барьеров. Biomed Pharmacother. 2004. 58: 168–72. [PubMed] [Google Scholar] 8. Арруэбо М., Фернандес-Пачеко Р., Ибарра М.Р., Сантамария Дж. Магнитные наночастицы для доставки лекарств.Нано сегодня. 2007; 2: 22–32. [Google Scholar] 9. Ashjari M, Khoeeb S, Mahdavian AR. Множественный эмульсионный метод загрузки 5-фторурацила в нанокапсулу, нагруженную магнетитом: физико-химическое исследование. Polym Int. 2012; 61: 850–9. [Google Scholar] 10. Асо С.И., Исэ Х., Такахаши М., Кобаяси С., Моримото Х., Идзава А. и др. Эффективное поглощение липосом, конъюгированных с N-ацетил-глюкозамином, кардиомиоцитами in vitro. J Control Release. 2007; 122: 189–98. [PubMed] [Google Scholar] 11. Астана А., Чаухан А.С., Диван П.В., Джайн Н.К.Дендритные наноструктуры поли (амидоамина) (ПАМАМ) для контролируемой сайт-специфической доставки кислого противовоспалительного активного ингредиента. AAPS PharmSci Tech. 2005; 6: E536 – E542. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Auzenne EA, Seeney CE, Hamir AN, Klostergaard J. Противоопухолевая активность магнитных наночастиц, нагруженных лекарством. IEEE Trans Magn. 2013; 49: 336–342. [Google Scholar] 13. Бабес Л., Денизот Б., Танги Г., Ле Жен Дж., Джалле П. Синтез наночастиц оксида железа, используемых в качестве контрастных агентов МРТ: параметрическое исследование.Коллоидный интерфейс Sci. 1999; 212: 474–482. [PubMed] [Google Scholar] 14. Баковски Х., Рихтер Т., Кнейер С., Хёкстра Д., Роте У., Бендас Г. и др. Характеристики адгезии и оценка стабильности липосом, модифицированных лектином, для сайт-специфической доставки лекарств. Biochim Biophys Acta. 2008; 1778: 242–9. [PubMed] [Google Scholar] 15. Банерджи С, Бенни Т.Х., Вонг СС. Ковалентная химия поверхности однослойных нанотрубок. Adv Mater. 2005; 17: 17–29. [Google Scholar] 16. Беккер К., Ходениус М., Блендингер Г., Сечи А., Иеронимус Т., Мюллер-Шульте Д. и др.Поглощение магнитных наночастиц клетками для отслеживания клеток. J Magn Magn Mater. 2007; 311: 234–7. [Google Scholar] 17. Бенито AM, Maniette Y, Munoz E, Martinez MT. Производство углеродных нанотрубок каталитическим пиролизом бензола. Углерод. 1998; 36: 681–3. [Google Scholar] 18. Бланко Э., Бей Э.А., Донг Й., Вайнберг Б.Д., Саттон Д.М., Бутман Д.А. и др. Полимерные мицеллы PEG-PLA, содержащие β-лапахон, как новые нанотерапевтические средства против опухолевых клеток, сверхэкспрессирующих NQO1. J Control Release. 2007; 122: 365–74. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19.Брюс И.Дж., Сен Т. Модификация поверхности магнитных наночастиц алкоксисиланами и их применение в магнитных биоразделениях. Ленгмюра. 2005; 21: 7029–7035. [PubMed] [Google Scholar] 20. Buhleier E, Wehner W, Vogtle F. Каскадный и нескользящий цепной синтез топологий молекулярных полостей. Синтез. 1978; 2: 155–158. [Google Scholar] 21. Кабрал Х., Нишияма Н., Катаока К. Оптимизация полимерных мицелл, нагруженных (1,2-диаминоциклогексан) платиной (II), направленная на улучшение воздействия на опухоль и усиление противоопухолевой активности.J Control Release. 2007; 121: 146–55. [PubMed] [Google Scholar] 22. Каннас С., Гаттески Д., Мусину А., Пиккалуга Г., Сангрегорио С. Структурные и магнитные свойства наночастиц Fe2O3, диспергированных на матрице диоксида кремния. J. Phys Chem B. 1998; 102: 7721–6. [Google Scholar] 23. Чабре Ю.М., Рой Р. Последние тенденции в синтезе и применении гликодендримеров. Curr Top Med Chem. 2008; 8: 1237–85. [PubMed] [Google Scholar] 24. Charles SW, Popplewell J. North-Holland Publ. Амстедам: Издательство Северной Голландии; 1980. Ферромагнитные материалы: справочник по свойствам магнитоупорядоченных веществ.[Google Scholar] 25. Чаухан А.С., Шридеви С., Чаласани К.Б., Джайн А.К., Джайнб С.К. и др. Дендример-опосредованная трансдермальная доставка: повышенная биодоступность индометацина. J Control Release. 2003. 90: 335–43. [PubMed] [Google Scholar] 26. Чен Д., Сюй Р. Гидротермальный синтез и характеристика нанокристаллических порошков Fe3O4. Mater Res Bull. 1998. 33: 1015–1021. [Google Scholar] 27. Чой Дж. С., Намб К., Пак Дж. Й., Ким Дж. Б., Ли Дж. К., Пак Дж. С.. Повышенная эффективность трансфекции дендримера PAMAM за счет модификации поверхности L-аргинином.J Control Release. 2004. 99: 445–56. [PubMed] [Google Scholar] 28. Колтье Дж. П., Шейз Б., Винтерхальтер М., Фурнье Д. Инкапсуляция белка в липосомах: эффективность зависит от взаимодействий между белком и фосфолипидным бислоем. BMC Biotechnol. 2002; 2: 1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Костин Г.Е., Триф М., Ничита Н., Двек Р.А., Петреску С.М. pH-чувствительные липосомы являются эффективными носителями лекарственных средств, нацеленных на эндоплазматический ретикулум, в клетках меланомы мыши, Biochem Biophys Res Commun. Biochem Biophys Res Commun.2002; 293: 918–23. [PubMed] [Google Scholar] 30. Крэмптон Х.Л., Симанек Э. Дендримеры как средства доставки лекарств: нековалентные взаимодействия биоактивных соединений с дендримерами. Polym Int. 2007. 56: 489–96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Crespo L, Sanclimens G, Pons M, Giralt E, Royo M, Albericio F. Дендримеры, содержащие пептидные и амидные связи. Chem Rev.2005; 105: 1663–1681. [PubMed] [Google Scholar] 32. Добровольская М.А., Макнил С.Е. Иммунологические свойства созданных наноматериалов.Nature Nanotechnol. 2007; 2: 469–478. [PubMed] [Google Scholar] 33. Ellens H, Bentz J, Szoka FC., Jr pH-индуцированная дестабилизация липосом, содержащих фосфатидилэтаноламин: роль двухслойного контакта. Биохимия. 1984; 23: 1532–1538. [PubMed] [Google Scholar] 34. Фараджи М., Ямини Ю., Резаи М. Магнитные наночастицы: синтез, стабилизация, функционализация, характеристика и приложения. J Iran Chem Soc. 2010; 7: 1–37. [Google Scholar] 35. Фельнерова Д., Вирет Дж.Ф., Глюк Р., Мозер С. Липосомы и виросомы как системы доставки антигенов, нуклеиновых кислот и лекарств.Current Opin Biotechnol. 2004; 15: 518–529. [PubMed] [Google Scholar] 36. Форрест М.Л., Вон CY, Малик А.В., Квон Г.С. Высвобождение in vitro ингибитора mTOR рапамицина из мицелл поли (этиленгликоль) -b-поли (е-капролактон). J Control Release. 2006; 110: 370–77. [PubMed] [Google Scholar] 37. Форрест М.Л., Чжао А., Вон CY, Малик А.В., Квон Г.С. Липофильные пролекарства гелданамицина, ингибитора Hsp90, для наноинкапсулирования в мицеллах поли (этиленгликоль) -b-поли (ε-капролактон). J Control Release. 2006. 116: 139–49.[PubMed] [Google Scholar] 38. Франк С., Пончарал П., Ван З.Л., де Хир В.А. Квантовые резисторы из углеродных нанотрубок. Наука. 1998. 280: 1744–6. [PubMed] [Google Scholar] 39. Funhoff AM, Monge S, Teeuwen R, Koning GA, Schuurmans-Nieuwenbroek NME, Crommelin DJA и др. Полиэтиленгликоль-экранированные полимерные двухслойные мицеллы для доставки генов. J Control Release. 2005; 102: 711–24. [PubMed] [Google Scholar] 40. Галиндо-Родригес С., Аллеманн Э., Фесси Х., Дёлькер Э. Физико-химические параметры, связанные с образованием наночастиц в методах высаливания, эмульгирования-диффузии и нанопреципитации.Pharm Res. 2004; 21: 1428–39. [PubMed] [Google Scholar] 41. Гариепи Э.Р., Леклерб Г., Хильдген П., Гупта А., Леру Дж. Термочувствительный гидрогель на основе хитозана, содержащий липосомы для доставки гидрофильных молекул. J Control Release. 2002; 82: 373–83. [PubMed] [Google Scholar] 42. Гоше Г., Дюфресн М.Х., Сант В.П., Канг Н., Майзингер Д., Леру Дж. Блок-сополимерные мицеллы: получение, характеристика и применение в доставке лекарств. J Control Release. 2005; 109: 169–88. [PubMed] [Google Scholar] 43. Гогоция Ю., Либера Я.Гидротермальный синтез многослойных углеродных нанотрубок. J Mater Res. 2000; 15: 2591–2594. [Google Scholar] 44. Гойны Ф.Х., Настальчик Дж., Росланец З., Шульте К. Поверхностно-модифицированные многостенные углеродные нанотрубки в УНТ / эпоксидных композитах. Chem Phys Lett. 2003. 370: 820–4. [Google Scholar] 45. Греф Р., Домб А., Квеллек П., Бланк Т., Мюллер Р. Х., Вербаватц Дж. М. и др. Контролируемая внутривенная доставка лекарств с помощью стерически стабилизированных наносфер, покрытых ПЭГ. Adv Drug Deliv Rev., 1995; 16: 215–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46.Го Т., Николаев П., Тесс А., Колберт Д. Т., Смолли Р. Э. Каталитический рост однослойных нанотрубок методом лазерного испарения. Chem Phys Lett. 1995; 243: 49–54. [Google Scholar] 47. Guo X, Szoka FC., Jr. Стерическая стабилизация фузогенных липосом с помощью конъюгата ПЭГ-диортоэфир-липид, чувствительного к низкому pH. Bioconjug Chem. 2001; 12: 291–300. [PubMed] [Google Scholar] 48. Гупта А., Гупта М. Подавление цитотоксичности и повышение клеточного поглощения поверхностно-модифицированных магнитных наночастиц. Биоматериалы. 2005; 26: 1565–1573.[PubMed] [Google Scholar] 49. Гупта А.К., Кертис А.С.Г. Поверхностно модифицированные супрамагнитные наночастицы для доставки лекарств: исследования взаимодействия с человеческими фибробластами в культуре. J Mater Sci – Mater Med. 2004. 15: 493–496. [PubMed] [Google Scholar] 50. Hafeli UO. Магнитно-модулированные терапевтические системы. Int J Pharm. 2004; 277: 19–24. [PubMed] [Google Scholar] 51. Хампель С., Кунце Д., Хассе Д., Крамер К., Раушенбах М., Ритчел М. и др. Углеродные нанотрубки, заполненные химиотерапевтическим агентом: наноноситель опосредует ингибирование роста опухолевых клеток.Наномедицина. 2008. 3: 175–182. [PubMed] [Google Scholar] 52. Хасани С.Ф., Ахмед И., Раджан Дж, Рехман А. Систематический обзор методов получения магнитных наночастиц оксида железа. Nanosci Nanotechnol. 2012; 2: 148–158. [Google Scholar] 53. Hawker CJ, Frechet JMJ. Получение полимеров с контролируемой молекулярной архитектурой: новый конвергентный подход к дендритным макромолекулам. J Am Chem Soc. 1990; 112: 7638–7647. [Google Scholar] 54. Herreyre S, Gadelle P. Влияние водорода на морфологию углерода, осажденного в результате каталитического диспропорционирования CO.Углерод. 1995; 33: 234–7. [Google Scholar] 55. Huh KM, Lee SC, Cho YW, Lee J, Jeong JH, Park K. Гидротропная полимерная мицеллярная система для доставки паклитаксела. J Control Release. 2005. 101: 59–68. [PubMed] [Google Scholar] 56. Идзима С. Винтовые микротрубки из графитового углерода. Природа. 1991; 354: 56–8. [Google Scholar] 57. Исмаил А.А. Синтез и характеристика наночастиц Y2O3 / Fe2O3 / TiO2 золь-гель методом. Appl Catalysis. 2005; B58: 115–21. [Google Scholar] 58. Яна Н.Р., Чен Й., Пэн Х. Размер и форма контролируемых нанокристаллов магнитных (Cr, Mn, Fe, Co, Ni) оксидов с помощью простого и общего подхода.Chem Mater. 2004; 16: 3931–5. [Google Scholar] 59. Jevprasesphant R, Penny J, Attwood D, McKeown NB, Emanuele AD. Разработка поверхностей дендримеров для усиления трансэпителиального транспорта и снижения цитотоксичности. Pharm Res. 2003. 20: 1543–1550. [PubMed] [Google Scholar] 60. Цзян Л., Гао Л. Модифицированные углеродные нанотрубки: эффективный способ селективного прикрепления наночастиц золота. Углерод. 2003. 41: 2923–9. [Google Scholar] 61. Kale M, Suruse P, Singh R, Malhotra G, Raut P. Влияние методов уменьшения размера на липосомы, нагруженные гидрохлоридом доксорубицина.Int J Biol Pharm Res. 2012; 3: 308–316. [Google Scholar] 62. Каратанасис Э., Айягари А.Л., Бхаване Р., Белламкон Р.В., Аннапрагада А.В. Приготовление расщепляемых агломерированных липосом in vivo, подходящих для модулированной доставки лекарств в легкие. J Control Release. 2005. 103: 159–75. [PubMed] [Google Scholar] 63. Кэти Дж., Ри К.Ю. Модификация поверхности многослойных углеродных нанотрубок с использованием 3-аминопропилтриэтоксисилана. J Mater Sci. 2008; 43: 33–7. [Google Scholar] 64. Кавано К., Ватанабе М., Ямамото Т., Йокояма М., Опанасопит П., Окано Т. и др.Усиление противоопухолевого действия камптотецина, содержащегося в полимерных мицеллах с длительной циркуляцией. J Control Release. 2006; 112: 329–32. [PubMed] [Google Scholar] 65. Ким Э. Х., Ли Х. С., Квак Б. К., Ким Б. К.. Синтез феррожидкости с магнитными наночастицами сонохимическим методом для контрастного вещества для МРТ. J Magn Magn Mater. 2005. 289: 328–330. [Google Scholar] 66. Kim JS, Yoon TJ, Yu KN, Noh MS, Woo M, Kim BG и др. Поглощение магнитными наночастицами клетками опосредуется энергозависимым эндоцитозом в клетках A549.J Vet Sci. 2006; 7: 321–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Kim Y, Klutz AM, Jacobson KA. Систематическое исследование дендримеров полиамидоаминов, поверхностно модифицированных полиэтиленгликолем, для приложений доставки лекарств: синтез, характеристика и оценка цитотоксичности. Bioconjugate Chem. 2008; 19: 1660–72. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Клайнерт Б., Брыжевска М. Дендримеры: свойства и применение. Acta Biochim Pol. 2001. 48: 199–208. [PubMed] [Google Scholar] 70.Kohler N, Sun C, Wang J, Zhang M. Суперпарамагнитные наночастицы, модифицированные метотрексатом, и их внутриклеточное проникновение в раковые клетки человека. Ленгмюра. 2005; 21: 8858–64. [PubMed] [Google Scholar] 71. Колхе П., Мисра Э., Каннан Р.М., Каннан С., Лие-Лай М. Комплексообразование лекарств, высвобождение in vitro и проникновение в клетки дендримеров и гиперразветвленных полимеров. Int J Pharm. 2003. 259: 143–60. [PubMed] [Google Scholar] 72. Kong J, Zhou C, Morpurgo A, Soh HT, Quate CF, Marcus C. Синтез, интеграция и электрические свойства отдельных однослойных углеродных нанотрубок.Appl Phys A Mater. 1999; 69: 305–8. [Google Scholar] 73. Кенигсберг П.Дж., Годтел Р., Киссель Т., Ричер Л.Л. Разработка липосом, конъюгированных с ИЛ-2, для терапевтических целей. Biochim Biophys Acta. 1998; 1370: 243–251. [PubMed] [Google Scholar] 74. Кумар М., Андо Ю. Химическое осаждение из газовой фазы углеродных нанотрубок: обзор механизма роста и массового производства. J Nanosci Nanotechol. 2010; 10: 3739–58. [PubMed] [Google Scholar] 75. Кумари А, Ядав СК. Клеточные взаимодействия терапевтически доставленных наночастиц.Exp Opinion Drug Deliv. 2011; 8: 141–151. [PubMed] [Google Scholar] 76. Кумари А., Ядав С.К., Пакаде Ю.Б., Сингх Б., Ядав СК. Разработка биоразлагаемых наночастиц для доставки кверцетина. Colloids Surf B. 2010; 80: 184–92. [PubMed] [Google Scholar] 77. Кумари А, Ядав СК, Ядав СК. Системы доставки лекарств на основе биоразлагаемых полимерных наночастиц. Colloids Surf B. 2010; 75: 1–18. [PubMed] [Google Scholar] 78. Квон Г.С. Полимерные мицеллы для доставки плохо растворимых в воде соединений. Crit Rev Ther Drug Carr Syst.2003. 20: 357–403. [PubMed] [Google Scholar] 79. Квон Г.С., Наито М., Йокояма М., Окано Т., Сакураи Ю., Катаока К. Физическое улавливание адриамицина в мицеллах блок-сополимера AB. Pharm Res. 1995; 12: 192–5. [PubMed] [Google Scholar] 80. Лай П.С., Лу П.Дж., Пэн Ц.Л., Пай Ц.Л., Йен В.Н., Хуанг М.Ю. и др. Доставка доксорубицина путем конъюгации полиамидоаминных дендримеров и фотохимической интернализации для лечения рака. J Control Release. 2007; 122: 39–46. [PubMed] [Google Scholar] 81. Ли ES, Na K, Bae YH. Полимерные мицеллы для определения pH опухоли и нацеливания, опосредованного фолатом.J Control Release. 2003; 9: 103–13. [PubMed] [Google Scholar] 82. Лиггинс RT, Берт HM. Диблок-сополимеры простого полиэфира и сложного полиэфира для получения композиций полимерных мицелл, нагруженных паклитакселом. Adv Drug Deliv Rev. 2002; 54: 191–202. [PubMed] [Google Scholar] 83. Лю Ц., Фань YY, Лю М., Цун HT, Ченг Х.М., Dresselhaus MS. Хранение водорода в однослойных углеродных нанотрубках при комнатной температуре. Наука. 1999; 286: 1127–9. [PubMed] [Google Scholar] 84. Лю С., Цзоу Б., Рондиноне А.Дж., Чжан З.Дж. Обратный синтез мицелл и характеристика суперпарамагнитных нанокристаллитов феррита шпинели mnfe2o4.J. Phys Chem B. 2000; 104: 1141–5. [Google Scholar] 85. Лю З., Чен К., Дэвис С., Шерлок С., К. Цао, Чен Х и др. Доставка лекарств с помощью углеродных нанотрубок для лечения рака in vivo. Cancer Res. 2008. 68: 6652–6660. [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Лю З., Табакман С., Велшер К., Дай Х. Углеродные нанотрубки в биологии и медицине: обнаружение in vitro и in vivo, визуализация и доставка лекарств. Nano Res. 2009; 2: 85–120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87. Лукьянов А.Н., Хартнер В.К., Торчилин В.П.Повышенное накопление мицелл ПЭГ – ПЭ в зоне экспериментального инфаркта миокарда у кроликов. J Control Release. 2004; 94: 187–93. [PubMed] [Google Scholar] 88. Ма RZ, Wei BQ, Xu CL, Liang J, Wu DH. Изменение морфологии углеродных нанотрубок под действием лазерного излучения. Углерод. 2000; 38: 636–8. [Google Scholar] 89. Махешвари РГО, Текаде Р.К., Шарма П.А., Дарвекар Дж., Тьяги А., Патель Р.П. и др. Этосомы и ультрадеформируемые липосомы для трансдермальной доставки клотримазола: сравнительная оценка.Сауди Фарм Дж. 2012; 20: 161–70. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Марин А., Сан Х., Хусейни Г.А., Питт В.Г., Кристенсена Д.А., Рапопорт, штат Нью-Йорк. Доставка лекарств в мицеллах плюроника: влияние высокочастотного ультразвука на высвобождение лекарства из мицелл и внутриклеточное поглощение. J Control Release. 2002; 84: 39–47. [PubMed] [Google Scholar] 91. Массарт Р. Приготовление водных магнитных жидкостей в щелочных и кислых средах. IEEE Trans Magn. 1981; 17: 1247–8. [Google Scholar] 92. Матур С., Шен Х. Структурные и физические свойства La2 / 3Ca1 / 3MnO3, полученного модифицированным золь-гель методом.J Sol-Gel Sci Technol. 2002. 25: 147–57. [Google Scholar] 93. Мишра И. Дендример: новая система доставки лекарств. J Drug Delivery Therapeut. 2011; 1: 70–74. [Google Scholar] 95. Мойсала А., Насибулин А.Г., Браун Д.П., Цзян Х., Хряччев Л., Кауппинен Э. Синтез одностенных углеродных нанотрубок с использованием ферроцена и пентакарбонила железа в реакторе с ламинарным потоком. Chem Eng Sci. 2006; 61: 4393–4402. [Google Scholar] 96. Morgan MT, Nakanishi Y, Kroll DJ, Griset AP, Carnahan MA, Wathier M и др. Инкапсулированные в дендримеры камптотецины: повышенная растворимость, клеточное поглощение и клеточная задержка обеспечивают повышенную противораковую активность in vitro.Cancer Res. 2006; 66: 11913–11921. [PubMed] [Google Scholar] 97. Муньос Хавьер А., Крефт О, Пьера Альберола А., Киршнер С., Зебли Б., Суша А.С. и др. Комбинированная атомно-силовая микроскопия и измерения оптической микроскопии как метод исследования поглощения частиц клетками. Небольшой. 2006; 2: 394–400. [PubMed] [Google Scholar] 98. Накагава Х., Такахаши Т., Котани Х., Секино М., Котани М., Уэно С. Улучшение стабилизации и потенциала слияния клеток парамагнитных липосом для применения в системе доставки лекарств.Серия Int Cong. 2007; 1300: 315–18. [Google Scholar] 99. Needham D, Dewhirst MW. Разработка и тестирование новой термочувствительной системы доставки лекарств для лечения солидных опухолей. Adv Drug Deliv Rev. 2001; 53: 285–305. [PubMed] [Google Scholar] 100. Ньюкоме Г.Р., Яо ZQ, Бейкер Г.Р., Гупта В.К. Каскадные молекулы: новый подход к мицеллам. J Org Chem. 1985; 50: 2003–6. [Google Scholar] 101. Ниу Л., Мэн Л., Лу К. Фолат-конъюгированный ПЭГ на однослойных углеродных нанотрубках для нацеленной доставки доксорубицина в раковые клетки.Macromol Biosci. 2013; 13: 735–44. [PubMed] [Google Scholar] 102. Ооя Т., Ли Дж., Парк К. Влияние привитых, звездообразных и дендритных полимеров на основе этиленгликоля на солюбилизацию и контролируемое высвобождение паклитаксела. J Control Release. 2003; 93: 121–7. [PubMed] [Google Scholar] 103. Pan BF, Cui DX, Xu P, Huang T, Li Q, He R и др. Повышение клеточного поглощения однослойных углеродных нанотрубок, модифицированных дендримером полиамидоамина. Международная конференция по биомедицинской и фармацевтической инженерии, 11-14 декабря.2006 ICBPE; Сингапур: 2007. С. 541–544. [Google Scholar] 104. Пак Е.К., Ким СИ, Ли С.Б., Ли Ю.М. Конъюгированные с фолатом метоксиполи (этиленгликоль) / поли (е-капролактон) амфифильные блок-сополимерные мицеллы для нацеленной на опухоль доставки лекарств. J Control Release. 2005; 109: 158–68. [PubMed] [Google Scholar] 105. Peer D, Karp JM, Hong S, Farokhzad OC, Margalit R, Langer R. Наноносители как новая платформа для лечения рака. Nature Nanotechnol. 2007; 2: 751–760. [PubMed] [Google Scholar] 106. Цянь Д., Вагнер Г.Дж., Лю В.К.Механика углеродных нанотрубок. Appl Mech Rev. 2002; 55: 495–433. [Google Scholar] 107. Resasco DE, Alvarez WE, Pompeo F, Balzano L, Herrera JE, Kitiyanan B, et al. Масштабируемый процесс производства однослойных углеродных нанотрубок (ОСУНТ) путем каталитического диспропорционирования CO на твердом катализаторе. J Nanopart Res. 2002; 4: 131–6. [Google Scholar] 108. Rijcken CJF, Soga O, Hennink WE, Nostrum CFV. Вызванная дестабилизация полимерных мицелл и везикул путем изменения полярности полимеров: привлекательный инструмент для доставки лекарств.J Control Release. 2007. 120: 131–48. [PubMed] [Google Scholar] 109. Родригес Л.С., Лафонтен М.М., Кастро С., Вега Дж. М., Эстевес М.Л., Хуан Э.Дж. и др. Синтез, стабильность, клеточное поглощение и время кровообращения магнитных наночастиц, покрытых карбоксиметил-инсулином. J Mater Chem B. 2013; 1: 2807–17. [Бесплатная статья PMC] [PubMed] [Google Scholar] 110. Rouhollah K, Pelin M, Serap Y, Gozde U, Ufuk G. Загрузка доксорубицина, высвобождение и стабильность магнитных наночастиц, покрытых полиамидоаминовым дендримером. J Pharm Sci.2013; 102: 1825–35. [PubMed] [Google Scholar] 111. Santhakumaran LM, Thomas T, Thomas TJ. Повышенное поглощение клетками олигонуклеотида, образующего триплекс, за счет образования наночастиц в присутствии дендримеров полипропиленимина. Nucleic Acids Res. 2004. 32: 2102–2112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Сантра С., Тапек Р., Теодоропулу Н., Добсон Дж., Хебард А., Тан В. Синтез и характеристика наночастиц оксида железа, покрытых диоксидом кремния, в микроэмульсии: влияние неионных поверхностно-активных веществ.Ленгмюра. 2001; 17: 2900–6. [Google Scholar] 113. Себестик Дж., Нидерхафнер П., Джезек Дж. Пептидные и гликопептидные дендримеры и аналогичные дендримерные структуры и их биомедицинские применения. Аминокислоты. 2011; 40: 301–70. [PubMed] [Google Scholar] 114. Шафи КПМ, Геданкен А., Прозоров Р. Сонохимическая подготовка и определение характеристик наноразмерных порошков аморфного сплава Co – Ni. J Mater Chem. 1998. 8: 769–73. [Google Scholar] 115. Шао К., Хоу Ц., Дуан В., Го М.Л., Вонг К.П., Ли QT. Внутриклеточная доставка лекарств с помощью сульфатид-опосредованных липосом к глиомам.J Control Release. 2006; 115: 150–7. [PubMed] [Google Scholar] 116. Ши Г., Го В., Стивенсон С.М., Ли Р.Дж. Эффективная внутриклеточная доставка лекарств и генов с использованием рН-чувствительных липосом, нацеленных на рецепторы фолиевой кислоты, состоящих из комбинаций катионных / анионных липидов. J Control Release. 2002; 80: 309–19. [PubMed] [Google Scholar] 117. Silambarasi T, Latha S, Thambidurai M, Selvamani P. Составление и оценка нагруженных куркумином магнитных наночастиц для лечения рака. IJPSR. 2012; 3: 1393–1400. [Google Scholar] 119.Синико С, Манкони М, Пеппи М, Лай Ф, Валенти Д., Фадда AM. Липосомы как носители дермальной доставки третиноина: оценка проникновения лекарственного средства и взаимодействия пузырьков с кожей in vitro. J Control Release. 2005. 103: 123–36. [PubMed] [Google Scholar] 120. Соппиматх К.С., Аминабхави TM, Кулкарни А.Р., Рудзински В.Е. Биоразлагаемые полимерные наночастицы как устройства доставки лекарств. J Control Release. 2001; 70: 1–20. [PubMed] [Google Scholar] 121. Шторм С., Беллиот С.О., Дэймен Т., Ласич Д.Д. Модификация поверхности наночастиц для противодействия захвату моноядерной системой.Adv Drug Deliv Rev. 1995; 17: 31–48. [Google Scholar] 123. Таканаши К., Ямамото К. Дивергентный подход к синтезу и терминальным модификациям дендритных полифенилазометинов. Org Lett. 2007; 9: 5151–5154. [PubMed] [Google Scholar] 124. Томалия Д.А., Бейкер Х., Девальд Дж., Холл М., Каллос Г., Мартин С. и др. Новый класс полимеров: звездо-дендритные макромолекулы. Полим Дж. 1985; 17: 117–132. [Google Scholar] 125. Томалия Д.А., Фреше Дж.М.Дж. Открытие дендримеров и дендритных полимеров: краткая историческая перспектива.J. Polym Sci. Часть A: Polym Chem. 2002; 40: 2719–2728. [Google Scholar] 126. Turano SP, Ready J. Синтез самовыравнивающихся массивов углеродных нанотрубок путем химического осаждения из газовой фазы. J Electron Mater. 2006. 35: 192–194. [Google Scholar] 127. Ватта Л.Л., Сандерсон Р.Д., Кох КР. Магнитные наночастицы: свойства и возможности применения. Pure Appl Chem. 2006; 78: 1793–1801. [Google Scholar] 128. Верма А., Стеллаччи Ф. Влияние поверхностных свойств на взаимодействия наночастиц и клеток. Небольшой. 2010; 6: 12–21. [PubMed] [Google Scholar] 129.Ван Дж., Рен Ф., Йи Р., Ян А., Цю Дж., Лю X. Сольвотермический синтез и магнитные свойства наночастиц феррита никеля с контролируемым размером. J Сплавы Compd. 2009; 479: 791–796. [Google Scholar] 130. Weissleder R, Kelly K, Sun EY, Shtatland T, Josephson L. Клеточно-специфическое нацеливание наночастиц путем мультивалентного присоединения небольших молекул. Nat Biotechnol. 2005; 23: 1418–1423. [PubMed] [Google Scholar] 131. Уильямс Д.Н., Голд К.А., Холоман ТРП, Эрман С.Х., Уилсон О.К. Модификация поверхности магнитных наночастиц с помощью гуммиарабика.J Nanopart Res. 2006; 8: 749–53. [Google Scholar] 132. Уильямс MJ, Corr SA. Магнитные наночастицы для целевой диагностики и терапии рака. В: Саммерс HD, редактор. Границы нанонауки. Наномедицина. Vol. 5. Амстердам: Elsevier Science. С. 29–63. [Google Scholar] 133. Вонг EW, Sheehan PE, Lieber CM. Механика нанопучка: эластичность, прочность и ударная вязкость наностержней и нанотрубок. Наука. 1997; 277: 1971–5. [Google Scholar] 134. Ву В., Ли Р, Биан Х, Чжу З., Дин Д, Ли Х и др. Ковалентное соединение углеродных нанотрубок с противоопухолевым агентом: препарат и противоопухолевое действие.САУ Нано. 2009; 3: 2740–50. [PubMed] [Google Scholar] 135. Xiong XB, Huang Y, Lu WL, Zhang X, Zhang H, Nagai T. и др. Усиленная внутриклеточная доставка и улучшенная противоопухолевая эффективность доксорубицина за счет стерически стабилизированных липосом, модифицированных синтетическим миметиком RGD. J Control Release. 2005; 107: 262–75. [PubMed] [Google Scholar] 136. Сюй З., Шэнь Ц., Тянь И, Ши Х, Гао Х.Дж. Органический фазовый синтез монодисперсных нанокристаллов оксида железа с использованием хлорида железа в качестве прекурсора. Наноразмер. 2010; 2: 1027–32. [PubMed] [Google Scholar] 138.Ямамото Т., Йокояма М., Опанасопит П., Хаяма А., Кавано К., Майтани Ю. Каковы определяющие факторы для стабильного включения лекарственного средства в полимерные носители мицелл? Учет физико-химических характеристик внутреннего ядра мицеллы. J Control Release. 2007; 123: 11–8. [PubMed] [Google Scholar] 139. Ямамото Ю., Нагасаки Ю., Като Ю., Сугияма Ю., Катаока К. Длинно циркулирующие мицеллы блок-сополимера поли (этиленгликоль) –поли (d, l-лактид) с модулированным зарядом поверхности. J Control Release. 2001; 77: 27–38.[PubMed] [Google Scholar] 140. Йокояма М., Фукусима С., Уэхара Р., Окамото К., Катаока К., Сакураи Ю. и др. Характеристика физического захвата и химической конъюгации адриамицина в полимермицеллах и их дизайн для доставки к солидной опухоли. J Control Release. 1998. 50: 79–92. [PubMed] [Google Scholar] 141. Yoo HS, Oh JE, Lee KH, Park TG. Биоразлагаемые наночастицы, содержащие конъюгат доксорубицин-PLGA для замедленного высвобождения. Pharm Res. 1999; 16: 1114–8. [PubMed] [Google Scholar] 142.Цзэн Х., Чжу Л., Хао ГМ, Шэн РС. Синтез различных форм углеродных нанотрубок дуговым разрядом переменного тока. Углерод. 1998. 36: 259–61. [Google Scholar] 143. Zhang JX, Zalipsky S, Mullah N, Pechar M, Allen TM. Pharmaco представляет липосомы диолеоилфосфатидилэтаноламин / холестерилгемисукцинат, содержащие различные типы расщепляемых липополимеров. Pharmacol Res. 2004. 49: 185–198. [PubMed] [Google Scholar] 144. Zhang Z, Grijpma DW, Feijen J. Термочувствительный переход пленок монометокси-поли (этиленгликоль) -блок-поли (триметиленкарбонат) к мицеллярным наночастицам.J Control Release. 2006; 112: 57–63. [PubMed] [Google Scholar] 145. Чжоу В.Й., Го Б., Лю М., Ляо Р., Раби А.Б., Цзя Д. Бионанокомпозитные пленки из поли (винилового спирта) / галлуазитных нанотрубок: свойства и реакция остеобластов и фибробластов in vitro. J Biomed Mater Res A. 2010; 93: 1574–1587. [PubMed] [Google Scholar]Инкапсуляция лекарств для дозирования, ориентированного на пациента
Системы с несколькими частицами
Фармацевтическая промышленность давно осознала преимущества систем с несколькими частицами для улучшения фармакокинетического поведения и повышения биодоступности составов.По сравнению с монолитными устройствами, мультичастицы обладают меньшей вариабельностью опорожнения желудка, меньшей вариабельностью между и внутри субъектов, минимизируют риск сброса дозы и лучше способствуют индивидуальному высвобождению лекарственного средства.
Микрокапсулирование может быть определено как процесс, при котором частицы твердого или жидкого материала (ядро) покрываются сплошной пленкой из полимерного материала (оболочка) для получения капсул микрометрового или миллиметрового диапазона. Микрокапсулирование может быть достигнуто с использованием ряда химических или физических методов, включая межфазную полимеризацию, экструзионную сферонизацию, распылительную сушку и испарение растворителя, и это лишь некоторые из них.
Межфазная полимеризация включает полимеризацию мономера на поверхности двух несмешивающихся жидкостей (воды и органического растворителя). Мономеры растворяются в двух отдельных фазах, которые эмульгируются для достижения желаемого размера частиц. Мономеры полимеризуются на границе раздела капель эмульсии, тем самым инкапсулируя лекарство.
Экструзионная сферонизация — это двухэтапный процесс, в котором лекарственное средство и вспомогательные вещества объединяются и затем экструдируются с последующей сферонизацией экструдата для округления частиц.Экструзия горячего расплава (HME) в настоящее время используется для диспергирования API-интерфейсов в матрице на молекулярном уровне с образованием твердых растворов / дисперсий для улучшения растворения лекарственного средства. Распылительная сушка — это недорогой процесс микрокапсулирования, который широко используется для ароматизаторов и ароматизаторов. Частицы лекарства диспергируют в растворе полимера и распыляют в горячую камеру, и полимер затвердевает на частицах ядра по мере испарения растворителя. Испарение растворителя является распространенной техникой, при которой лекарственное средство либо растворяют, либо диспергируют в водной фазе в сочетании с полимером в органическом растворителе для создания эмульсии, а затем растворитель выпаривают с получением микросфер.
Другой метод — соэкструзия (гелевая технология Ethicap, Freund Pharmatec), которая может быть достигнута за счет использования вибрационной силы для перемещения материалов через концентрические сопла для создания капель, которые впоследствии образуют бесшовные миникапсулы за счет поверхностного натяжения в собирающей среде. Инкапсуляция лекарственного средства позволяет превращать жидкости в твердые вещества для поддержки последующей обработки, приспосабливает составы, увеличивающие растворимость и контролируемое высвобождение лекарственного средства, и может улучшить стабильность лекарственного средства.
Повышение растворимости и биодоступности
Более 40% пероральных лекарственных препаратов содержат плохо растворимые лекарственные средства (2). Подсчитано, что до 90% новых молекулярных образований попадают в категорию BCS класса II или IV, демонстрируя низкую и непостоянную биодоступность при пероральном введении in vivo (3). Соединения класса II BCS имеют плохую растворимость в воде, но приемлемую проницаемость, поэтому этапом, ограничивающим скорость абсорбции, является растворение лекарственного средства. Было разработано множество методов для решения проблемы плохой растворимости и биодоступности с разной степенью успеха.Основные технологии, направленные на достижение пероральной биодоступности плохо растворимых лекарств, включают использование микронизации, наноразмеров, инженерии кристаллов, твердых дисперсий, циклодекстринов, твердых липидных наночастиц и других коллоидных систем доставки лекарств, таких как микроэмульсии, самоэмульгирующиеся системы доставки лекарств, самоэмульгирование. микроэмульгирующие системы доставки лекарств и липосомы (4). В последние годы разработка аморфных твердых дисперсий с помощью HME позволила создать одну из самых эффективных технологий повышения биодоступности при пероральном введении (5).
Улучшения растворимости лекарств в микрокапсулированных системах достигаются, во-первых, за счет наличия множества частиц и соответствующей увеличенной площади поверхности, которая может увеличивать высвобождение лекарственного средства и последующее растворение. Во-вторых, некоторые методы микрокапсулирования позволяют включать усилители растворимости в состав или могут использовать температуры процесса выше точки плавления лекарственного средства для создания аморфной формы. Комбинация добавок к рецептуре и температуры выше точки плавления может применяться в некоторых случаях при использовании технологий HME или совместной экструзии.Такой комбинированный подход может привести к улучшению растворимости даже в большей степени, чем нанокристаллическая форма некоторых соединений класса II BCS. При использовании метода соэкструзии для выбранного соединения наблюдалось трехкратное увеличение растворимости в воде in vitro по сравнению с нанокристаллической формой (см. , фиг. 1, ).
В литературе сообщалось о многочисленных тематических исследованиях использования HME для улучшения пероральной биодоступности плохо растворимых лекарств. Fule и Amin разработали твердые дисперсионные формы немедленного высвобождения противоязвенного препарата лафутидина с использованием метода HME (6).Привитой сополимер поливинилкапролактам-поливинилацетат-полиэтиленгликоль (Soluplus, BASF) был использован в качестве основного солюбилизирующего агента с различными концентрациями выбранных поверхностно-активных веществ, таких как PEG 400, Lutrol F127 и Lutrol F68, для исследования влияния этих поверхностно-активных веществ на составы, обработанные HME. Скорость растворения и растворимость лафутидина были значительно увеличены в разработанных составах твердых дисперсий. Отношение полимера к поверхностно-активным веществам сыграло решающую роль в увеличении скорости растворения лафутидина, и в целом применение HME оказалось успешным в увеличении растворения in vitro.
Контролируемое высвобождение
Для некоторых методик микрокапсулирования контролируемое высвобождение лекарственного средства может быть достигнуто посредством самого метода инкапсуляции или путем последующего нанесения покрытия на инкапсулированные частицы лекарства. Множественные частицы обычно обеспечивают хорошую основу для нанесения полимерных покрытий с использованием обычных методов, таких как покрытие в псевдоожиженном слое. Основные достижения в области полимерных покрытий позволили настраивать высвобождение лекарственного средства на основе изменений pH или функций высвобождения по времени, но эффективность и характеристики покрытия зависят от ряда факторов, включая форму и распределение частиц по размерам.Различные доступные процессы микрокапсулирования демонстрируют изменчивую форму и свойства распределения по размерам, что может повлиять на эффективность покрытия.
Gowda et al. использовали распылительную сушку для приготовления микрочастиц индапамида с контролируемым высвобождением и сообщили, что этот подход обеспечивает 24-часовой профиль, сравнимый с имеющимся на рынке продуктом Lorvas (Indian Market) (7). Выбранные полимеры использовали для обеспечения функциональности с контролируемым высвобождением. Авторы пришли к выводу, что применение распылительной сушки в сочетании с выбранными вспомогательными веществами позволило разработать лекарственную форму с контролируемым высвобождением хорошо растворимого в воде лекарственного средства.
Для соэкструдированных миникапсул их сферическая форма и узкое распределение частиц по размерам (в пределах 3% по весу) могут способствовать равномерному нанесению полимерных покрытий (см. , рисунок 2, ). В этом случае покрытие из метакрилата с замедленным высвобождением было нанесено на миникапсулу, содержащую лекарственное средство класса II BCS. Высокая эффективность покрытия на множестве частиц может привести к действию замедленного высвобождения, сравнимому со специально разработанными устройствами замедленного высвобождения, такими как системы осмотических насосов (см. , рис. 3, ).
Комбинации лекарств
Схемы лечения, требующие использования нескольких препаратов, являются серьезным бременем для пациентов, и их соблюдение снижается с увеличением количества вводимых препаратов. Наиболее распространенными комбинациями лекарств являются комбинированные препараты с фиксированной дозой (FDC), в которых два или более лекарственных средства объединены в одной лекарственной форме в определенных дозах. Первые FDC представляли собой комбинации антиретровирусных препаратов для лечения ВИЧ / СПИДа, но другие комбинации использовались в качестве лечения одного или нескольких состояний (например,g., Pfizer’s Caduet, содержащий аторвастатин и амлодипин). Ключевым преимуществом FDC является улучшенная приверженность к лечению за счет уменьшения количества таблеток для пациентов. Бремя приема таблеток относится не только к количеству таблеток, которое должен принять пациент, но также и к бремени понимания различных инструкций к некоторым лекарствам.
Основной проблемой при составлении КПФД является химическая несовместимость между лекарствами. Обычно сообщается о взаимодействии между рифампицином и изониазидом (лекарствами, используемыми для лечения туберкулеза) при рН желудка, что приводит к плохой стабильности и биодоступности рифампицина.Экструзионную сферонизацию использовали для получения гранул рифампицина и изониазида с энтеросолюбильным покрытием. Состав показал улучшенную стабильность рифампицина в условиях in vitro (8). Концентрическая конструкция сопла с использованием метода капсулирования соэкструзией позволяет размещать до трех слоев внутри миникапсулы. Таким образом, средний слой может действовать как физический барьер между слоями лекарства (см. , рис. 4, ). Этот метод может устранить проблемы, связанные с несовместимостью, тем самым облегчая разработку стабильных продуктов FDC.
Удобные для пациента лекарственные формы
Удобные для пациента лекарственные формы обеспечивают очевидные преимущества для определенных групп пациентов, включая гериатрические и педиатрические группы, пациентов с дисфагией или пациентов с нейродегенеративными заболеваниями. Один из способов повысить комплаентность пациента — это создание удобных для приема лекарственных форм, а системы, состоящие из множества частиц, могут обеспечить различные варианты для удобных презентаций. Множественные частицы могут быть приготовлены в виде сухих сиропов или посыпок, которые можно добавлять в пищу, таблеток или гранул, диспергируемых перорально (ODT / ODG), и жидких составов.Такие лекарственные формы могут требовать маскировки вкуса и / или контролируемого высвобождения лекарственного средства, и их следует легко проглотить. Например, сферическая форма соэкструдированных бесшовных миникапсул облегчает глотание. Функциональность маскировки вкуса также может быть включена в оболочку миникапсул, что в некоторых случаях может устранить необходимость в дополнительном покрытии.
В других патентованных технологиях используются методы микрокапсулирования для маскировки вкуса горьких соединений, что особенно важно для педиатрической популяции.Например, запатентованный компанией Aptalis процесс коацервации Microcaps был использован для создания перорального гранулированного препарата с замаскированным вкусом тенофовира дизопроксил фумарата (Viread), который можно вводить путем смешивания с пищей для повышения приверженности педиатрическим пациентам.
При разработке новых продуктов, расширении ассортимента и дифференцированных дженериков рассмотрение соблюдения пациентом режима лечения имеет жизненно важное значение для улучшения клинических результатов, снижения затрат, связанных с многими заболеваниями, и уменьшения потерь, понесенных отраслью из-за несоблюдения режима лечения.Системы, состоящие из множества частиц, могут решить проблемы составления рецептур и позволить разработчику рецептур разработать удобную и подходящую для пользователя лекарственную форму.
Ссылки
1. Capgemini Consulting, «Расчетная годовая потеря доходов от фармацевтических препаратов из-за несоблюдения лекарств», по состоянию на 5 марта 2014 г.
2. C.A. Lipinski et al., Adv Drug Deliv Rev 46 (1-3) 3-26 (2001).
3. Ф. Кесисоглоу и Ю. Ву, AAPS J 10 (4) 516-525 (2008).
4. А. Фар и Х. Лю, Экспертное заключение, поставка лекарств 4 (4) 403-416 (2007).
5. J.C. DiNunzio et al., Pharm Technol , Drug Deliv Supp, s30-s37 (2010).
6. Р. Фюле и П. Амин, Asian J Pharm Sci ., Онлайн, DOI 10.1016 / j.ajps.2013.12.004 (31 декабря 2013 г.).
7. Д.В. Gowda, M.S. Хан и Р. Нагендра, Int J Pharm Bio Sci 1 (4) 459-466 (2010).
8. В. Кришна и М.С. Reddy, Asian J Pharm Clin Res 7 (Дополнение 1) 154-156 (2014).
Об авторе
Джоан ФитцПатрик — директор по развитию бизнеса и научным вопросам в Freund Pharmatec, Unit 1, IDA Business & Technology Park, Srah, Tullamore, Co.Оффали, Ирландия, электронная почта: [адрес электронной почты защищен]
Инкапсуляция и высвобождение наночастиц лекарственного средства в функциональные полимерные везикулы
Мы исследовали совместную сборку амфифильных диблок-сополимеров в растворах, содержащих лекарства и функциональные наночастицы, с использованием метода диссипативной динамики частиц (DPD). Контролируя размер и концентрацию функциональных наночастиц, длину гидрофобных блоков и параметры взаимодействия между гидрофобным блоком / растворителем и функциональными наночастицами, мы получили желаемые агрегаты для загрузки лекарств.Агрегаты, нагруженные лекарствами, могут быть дискообразными мицеллами, сферическими мицеллами и везикулами с функциональными наночастицами на поверхности. Когда среда растворителя изменяется, лекарства, загруженные в функциональные везикулы, могут высвобождаться в растворитель. Содержание высвобождения критически зависит от отталкивающего взаимодействия между лекарствами и растворителем. Получена динамическая кривая высвобождения лекарственного средства. Результат согласуется с экспериментами по высвобождению лекарства. Наши исследования показали, что мы можем точно контролировать образование функциональных пузырьков для загрузки и высвобождения лекарств.Загрузка лекарств в процессе самосборки и контроль высвобождения обладают широким потенциалом в области клинической медицины, а добавление функциональных наночастиц может оказать большую помощь в доставке лекарств и медицинской диагностике.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз? .
 Но профессор отмечает, почти все так и остаются демонстрациями, не уходя в медицину.
Главная причина: орган состоит из разных типов клеток, он должен быть пронизан сетью сосудов, нервных и лимфатических путей. Каждая клетка должна поверить, что она часть организма — ей нужны правильная кислотность, механическое напряжение, концентрация кислорода, сигнальные молекулы, связи с другими клетками. Вы не можете это просто напечатать. Не говоря уже об иммунной системе — она считает искусственный орган инородным телом и атакует его. Тогда вам нужно либо постоянно её дурачить (что сложно), либо подавлять. Где же выход?
Обратиться к ресурсам самого организма. Тот же аксолотль легко может отрастить заново лапу, даже часть мозга. Человек не может, но инструкции по созданию любой части тела у него есть, они “записаны в генах”. Профессор говорит: вместо того, чтобы прятаться от иммунной системы или бороться с ней, мы должны использовать ее силу. Лучшая стратегия — не создавать детали и заплатки, а найти те сигналы, что управляют регенерацией.
Но профессор отмечает, почти все так и остаются демонстрациями, не уходя в медицину.
Главная причина: орган состоит из разных типов клеток, он должен быть пронизан сетью сосудов, нервных и лимфатических путей. Каждая клетка должна поверить, что она часть организма — ей нужны правильная кислотность, механическое напряжение, концентрация кислорода, сигнальные молекулы, связи с другими клетками. Вы не можете это просто напечатать. Не говоря уже об иммунной системе — она считает искусственный орган инородным телом и атакует его. Тогда вам нужно либо постоянно её дурачить (что сложно), либо подавлять. Где же выход?
Обратиться к ресурсам самого организма. Тот же аксолотль легко может отрастить заново лапу, даже часть мозга. Человек не может, но инструкции по созданию любой части тела у него есть, они “записаны в генах”. Профессор говорит: вместо того, чтобы прятаться от иммунной системы или бороться с ней, мы должны использовать ее силу. Лучшая стратегия — не создавать детали и заплатки, а найти те сигналы, что управляют регенерацией.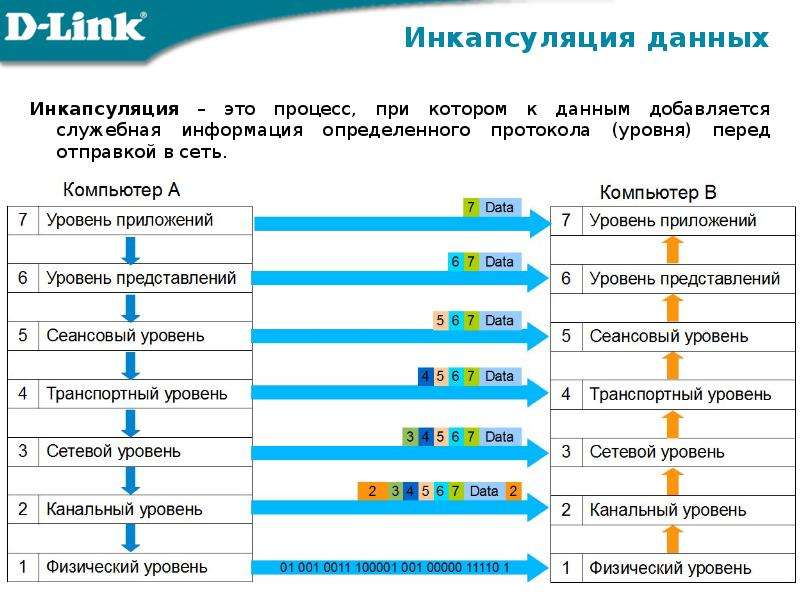 Тканевая инженерия будущего выглядит так: делаем “заготовку” органа, помещаем его в тело и подаем команду. Используем организм как биореактор — он делает основную работу.
Автор идет не в ногу с теми, кто любит фокусы типа “на 3D принтере напечатали ухо”. Кто видит ключ к успеху в развитии технологий: вот слепили “орган”, он быстро деградирует, отторгается, но мы доведем его до ума, сделаем биосовместимым. Ведь прогресс не остановить, будут новые материалы, новые решения. Тут не поспоришь, однако это — парадоксально — взгляд из прошлого, подход ХХ века.
Правда за профессором.
Медицина будет уходить от грубой механики, все больше станет искать вдохновение в резервах самого организма. Здесь та же линия, о чем я писал по случаю сделки Google и GlaxoSmithKline . Повторюсь, идея глубже, чем вопрос “как заменить почку”. Речь о том, чтобы мыслить как биологи, а не как инженеры (хотя это бывает полезно). Или еще шире — изменить “объект” на “субъект”.
Тканевая инженерия, электроника, импланты — будут развиваться, причем бурно и успешно.
Тканевая инженерия будущего выглядит так: делаем “заготовку” органа, помещаем его в тело и подаем команду. Используем организм как биореактор — он делает основную работу.
Автор идет не в ногу с теми, кто любит фокусы типа “на 3D принтере напечатали ухо”. Кто видит ключ к успеху в развитии технологий: вот слепили “орган”, он быстро деградирует, отторгается, но мы доведем его до ума, сделаем биосовместимым. Ведь прогресс не остановить, будут новые материалы, новые решения. Тут не поспоришь, однако это — парадоксально — взгляд из прошлого, подход ХХ века.
Правда за профессором.
Медицина будет уходить от грубой механики, все больше станет искать вдохновение в резервах самого организма. Здесь та же линия, о чем я писал по случаю сделки Google и GlaxoSmithKline . Повторюсь, идея глубже, чем вопрос “как заменить почку”. Речь о том, чтобы мыслить как биологи, а не как инженеры (хотя это бывает полезно). Или еще шире — изменить “объект” на “субъект”.
Тканевая инженерия, электроника, импланты — будут развиваться, причем бурно и успешно. Мы станем киборгами, о чем я и сам писал. Но это будет связано больше с усилением, расширением наших возможностей, взаимодействием с техносредой. То, что умеет организм, лучше отдать ему, не делать его работу. По кр. мере до тех пор, пока мы от организма не откажемся (во что я в обозримом будущем не верю)».
Мы станем киборгами, о чем я и сам писал. Но это будет связано больше с усилением, расширением наших возможностей, взаимодействием с техносредой. То, что умеет организм, лучше отдать ему, не делать его работу. По кр. мере до тех пор, пока мы от организма не откажемся (во что я в обозримом будущем не верю)». / Рисунок — Ася Ад.
/ Рисунок — Ася Ад. Есть некоторые основания так писать по той простой причине, что мне посчастливилось наблюдать процесс создания этой лаборатории, её развития, работу этого коллектива. Кроме того, мне приходится быть достаточно хорошо осведомлённым о том, что происходит в России в данной области науки. Абсолютно понимаю Елену и её мотивацию в этом интервью; конечно, «делать науку» — именно в кавычках произношу эти слова; «делать науку» — нехорошее словосочетание, но, тем не менее, в России заниматься биотехнологическими разработками архисложно. Тем более, в данном случае это происходит в рамках учреждения, подчинённого Минздраву, с достаточно урезанными бюджетами, поэтому работа в таких лабораториях — это «подвиг в мирное время». Это понятно, и это вызывает уважение. Но есть один нюанс: невозможно идти в ногу с зарубежными коллегами, если при этом работать на зарубежномоборудовании, реализовывать зарубежные мысли, идеи, концепции и так далее. Можно говорить о параллельном ходе в том случае, если мы работаем на отечественном оборудовании, с отечественными реактивами, потому что наука — это же не просто мысль и её реализация.
Есть некоторые основания так писать по той простой причине, что мне посчастливилось наблюдать процесс создания этой лаборатории, её развития, работу этого коллектива. Кроме того, мне приходится быть достаточно хорошо осведомлённым о том, что происходит в России в данной области науки. Абсолютно понимаю Елену и её мотивацию в этом интервью; конечно, «делать науку» — именно в кавычках произношу эти слова; «делать науку» — нехорошее словосочетание, но, тем не менее, в России заниматься биотехнологическими разработками архисложно. Тем более, в данном случае это происходит в рамках учреждения, подчинённого Минздраву, с достаточно урезанными бюджетами, поэтому работа в таких лабораториях — это «подвиг в мирное время». Это понятно, и это вызывает уважение. Но есть один нюанс: невозможно идти в ногу с зарубежными коллегами, если при этом работать на зарубежномоборудовании, реализовывать зарубежные мысли, идеи, концепции и так далее. Можно говорить о параллельном ходе в том случае, если мы работаем на отечественном оборудовании, с отечественными реактивами, потому что наука — это же не просто мысль и её реализация. Это вообще-то инфраструктура, созданная для проведения тех или иных научных исследований. Поэтому оборудование, реактивы, стандарты организации лабораторного и исследовательского процесса, сама тема тканевой инженерии в том виде, в котором она у нас воспроизводится — это же не наши идеи, давайте уж по-честному!? Это всё-таки имплантировано, перенесено к нам, как в своё время с Запада Пётр Первый переносил какие-то идеи, какие-то форматы. То же самое касается регенеративной медицины. Конечно, важные открытия, важные заслуги в этой области, безусловно, есть и у нас, но если говорить конкретно про контент сегодняшнего дня, давайте уж будем честными и откровенными, мы воспроизводим всё то, что однажды было кем-то сделано на Западе. Обогащая, совершенствуя, но по сути ведь нет же ни одной технологии, полностью своей.
XX2 ВЕК. То есть, догоняющая стратегия?
Р. Д. Разумеется. Понимаете, в чём дело: регенеративная медицина (в современном её понимании) — это пятнадцать-двадцать лет истории и работы; а лабораториям в Российской Федерации, которые могли быть созданы в рамках некоего инновационного тренда, который был при формировании политики инновационного развития, сколько? Десять лет? Восемь? Как вы хотите идти в ногу, когда мы в два раза отстаём чисто хронологически? Я не говорю про технологическое отставание.
Это вообще-то инфраструктура, созданная для проведения тех или иных научных исследований. Поэтому оборудование, реактивы, стандарты организации лабораторного и исследовательского процесса, сама тема тканевой инженерии в том виде, в котором она у нас воспроизводится — это же не наши идеи, давайте уж по-честному!? Это всё-таки имплантировано, перенесено к нам, как в своё время с Запада Пётр Первый переносил какие-то идеи, какие-то форматы. То же самое касается регенеративной медицины. Конечно, важные открытия, важные заслуги в этой области, безусловно, есть и у нас, но если говорить конкретно про контент сегодняшнего дня, давайте уж будем честными и откровенными, мы воспроизводим всё то, что однажды было кем-то сделано на Западе. Обогащая, совершенствуя, но по сути ведь нет же ни одной технологии, полностью своей.
XX2 ВЕК. То есть, догоняющая стратегия?
Р. Д. Разумеется. Понимаете, в чём дело: регенеративная медицина (в современном её понимании) — это пятнадцать-двадцать лет истории и работы; а лабораториям в Российской Федерации, которые могли быть созданы в рамках некоего инновационного тренда, который был при формировании политики инновационного развития, сколько? Десять лет? Восемь? Как вы хотите идти в ногу, когда мы в два раза отстаём чисто хронологически? Я не говорю про технологическое отставание. Чудес не бывает. Я не хочу говорить «догоняем — не догоняем», у каждого свой путь; видимо, мы идём своим путём, но надо понимать, что это «не в ногу», это мнение — самообман.
С Еленой, мы с ней это интервью не обсуждали… Но, ведь это читают люди, и они могут сделать неправильные выводы из прочитанного. С другой стороны, это было мнение одного эксперта. У меня другое мнение. Я не готов выступать в качестве ментора или поправлять чужое профессиональное мнение.
XX2 ВЕК. А по поводу высказывания Елены о том, что впереди сейчас страны Азии, Китай, что можете сказать?
Р. Д. Смотря в чём… А мы рецензируем то интервью, да? У нас такой формат беседы?
Чудес не бывает. Я не хочу говорить «догоняем — не догоняем», у каждого свой путь; видимо, мы идём своим путём, но надо понимать, что это «не в ногу», это мнение — самообман.
С Еленой, мы с ней это интервью не обсуждали… Но, ведь это читают люди, и они могут сделать неправильные выводы из прочитанного. С другой стороны, это было мнение одного эксперта. У меня другое мнение. Я не готов выступать в качестве ментора или поправлять чужое профессиональное мнение.
XX2 ВЕК. А по поводу высказывания Елены о том, что впереди сейчас страны Азии, Китай, что можете сказать?
Р. Д. Смотря в чём… А мы рецензируем то интервью, да? У нас такой формат беседы?
 Просто их было удобнее зарегистрировать в Китае. Там было быстрее провести клинические исследования, видимо на тот момент дешевле. Но получается, что это не китайская разработка.
XX2 ВЕК. Регистрация в Китае даёт возможность использовать их где-то ещё?
Р. Д. Нет, конечно, не даёт. Только в рамках того регулятора, который регистрировал. Регистрировала FDA (у них тоже FDA это называется) Китая, значит только в Китае и используются, если нет иных межгосударственных соглашений.
Если посмотреть на зарегистрированные и одобренные национальными регуляторами технологии, будь то генные, будь то клеточные, то, безусловно лидируют (может быть, пока) страны Запада. Если посмотреть на количество клинических исследований, — опять же, чисто математически, количественно, — то начинается конкуренция между Западом и Востоком в этом аспекте. Есть ли «выхлоп» из этого количества на сегодняшний день? Пока его нет.
Если посмотреть на законодательство, судя по всему, самое осмысленное, сбалансированное и friendly к разработчикам законодательство вообще в маленькой Японии.
Просто их было удобнее зарегистрировать в Китае. Там было быстрее провести клинические исследования, видимо на тот момент дешевле. Но получается, что это не китайская разработка.
XX2 ВЕК. Регистрация в Китае даёт возможность использовать их где-то ещё?
Р. Д. Нет, конечно, не даёт. Только в рамках того регулятора, который регистрировал. Регистрировала FDA (у них тоже FDA это называется) Китая, значит только в Китае и используются, если нет иных межгосударственных соглашений.
Если посмотреть на зарегистрированные и одобренные национальными регуляторами технологии, будь то генные, будь то клеточные, то, безусловно лидируют (может быть, пока) страны Запада. Если посмотреть на количество клинических исследований, — опять же, чисто математически, количественно, — то начинается конкуренция между Западом и Востоком в этом аспекте. Есть ли «выхлоп» из этого количества на сегодняшний день? Пока его нет.
Если посмотреть на законодательство, судя по всему, самое осмысленное, сбалансированное и friendly к разработчикам законодательство вообще в маленькой Японии. Поэтому ответ на Ваш вопрос пока не может быть однозначным. С точки зрения лабораторной части, да, наверное, страны Азии количеством побеждают, прежде всего, за счёт Китая. С точки зрения качества и выхода для медицины, пока преждевременно делать выводы об азиатском лидерстве в регенеративной медицине. Мы два-три года слышим мнения о том, что вот-вот китайское количество перейдёт в качество. Наверное, в технике это происходит, но в биотехе пока нет.
XX2 ВЕК. А в плане чего количество может перейти в качество? Чего ожидают от китайцев?
Р. Д. Да ничего особенного. Воспроизведения и быстрого проведения клинических исследований западных технологий.
XX2 ВЕК. Это всё?
Р. Д. Это моё оценочное суждение. Генную терапию не придумали в Китае, CRISPR/Cas9, коррекцию генома тоже не придумали в Китае. Когда китайская научная индустрия начнёт действительно генерировать технологии? Чёрт его знает. Пока не генерирует. Пока только заимствование и творческое развитие и переосмысление.
XX2 ВЕК. По-вашему, когда можно ожидать в России или даже в мире реально используемых тканеинженерных органов для лечения людей?
Р. Д. А зачем?
XX2 ВЕК. Что значит — «зачем»? Разве они не нужны?
Р. Д. Понимаете, у нас есть такой стереотип, что это очень нужно.
XX2 ВЕК. А разве нет? Не ждать донора…
Р. Д. Это всё красивые журналистские сказки, на самом деле. Они очень хороши для научпопа, очень неплохи для получения и реализации грантов, но для жизни, как показывает опыт, они далеки не то что от реализации, но даже от смысла этой реализации. Я здесь скептиком делаюсь.
Да, наверное, существуют единичные аппликации, где это имеет смысл, но я вообще не думаю, что человечество пойдёт этим путём. Это вечная журналистская весёлая история, которая берёт начало, мне кажется, из карикатур прошлого (если не позапрошлого) века, когда доктор приходит в аптеку и берёт с полки печень, почки, селезёнку… Это всё не технологично.
Мы с вами одинаково понимаем термин «тканевая инженерия»? Может быть, мы его понимаем по-разному? В классическом понимании, тканевая инженерия — это использование некоего матрикса, некое каркаса (скаффолда), синтетического или естественного, на который мы «посадили» клетки. И они, такие умные, «сели» туда, размножились и превратились в то, во что надо пациенту и врачу. Но мы же видим, что это не работает. Это не работает даже для таких качественно простых вещей, как костная ткань. Простых — насколько живая ткань вообще может быть простой. А уж для таких сложных, многокомпонентных структур как пищевод, трахея, лёгкое, печень — это вообще не путь. С научной точки зрения — это, конечно, интересное направление; а с практической — путь утилизации денежных знаков, не более того.
XX2 ВЕК. Но пытаются же в этом направлении что-то сделать. Вы считаете, что у всего этого будущего нет?
Р. Д. Много чего пытаются сделать, но это же не значит, что из этого всё получится. У подавляющего большинства разработок тканевой инженерии будущего, конечно, нет. Они будут вытеснены гораздо более эффективными и технологичными подходами ещё до момента фактического перехода в клиническую практику.
XX2 ВЕК. Например, какими?
Р. Д. Например, интересная технология, у всех на слуху, это, конечно, биопринтинг. Там катастрофическое количество проблем, и сейчас трудно делать прогнозы в этом плане, но в принципе она выглядит гораздо интереснее, чем тканевая инженерия. А то, что называется «дёшево и сердито» и что действительно позволяют биотехнологии — это, конечно, выращивание гуманизированных животных. Потому что это понятно и это относительно дёшево.
XX2 ВЕК. Гуманизированные животные — это животные, которым подсажены человеческие ткани?
Р. Д. В том числе. На самых ранних этапах эмбриогенеза. Впрочем, набирающие обороты технологии коррекции генома могут побороться с экспрессией антигенов. Вырастить свинью, с неиммуногенным подходящим по размеру сердцем, которое можно брать и трансплантировать, может оказаться гораздо дешевле, чем вырастить псевдосердце из псевдокардиомиоцитов на псевдокаркасе, активировать там псевдоэлектрическую систему электрического сопряжения для координированных сокращений этих псевдокардиомиоцитов; запустить туда псевдокоронарные сосуды, которые это всё будут кровоснабжать… Ещё раз говорю: это красиво для научной фантастики, это очень «прикольно» для научпопа и это недурно работало в прошлом десятилетии для получения грантов. Но к концу этого десятилетия на это даже гранты перестанут давать, потому что уже понятно, что это мыльный пузырь.
XX2 ВЕК. По-моему, пересадка свиного сердца человеку выглядит не менее фантастично.
Р. Д. Да нет, технологии есть, прототипы гуманизированных животных уже лет десять как существуют, над этими технологиями умные компании работают, доведут скоро, надеюсь.
XX2 ВЕК. И не будет отторгаться?
Р. Д. Вы у меня спрашиваете, как у бабушки Ванги. В теории, в идеологии этой технологии именно это свойство и заложено, иначе смысла не было бы. Любой организм животный — гораздо более дешёвый и гораздо более эффективный биореактор, чем все технологические навороты, которые используются, все эти ухищрения с наполовину промышленными, наполовину подвальной сборки биореакторами, всё это, к сожалению, и это тоже всего лишь личное оценочное суждение, не технологично. Это сиюминутно, для совершенно конкретных форм околонаучного бизнеса.
XX2 ВЕК. А какие в таком случае есть перспективные направления для использования стволовых клеток?
Р. Д. Мы всегда должны называть вещи своими именами. Вы о каких стволовых клетках спрашиваете? Потому что, например, есть гемопоэтические стволовые клетки, и мы не можем говорить о перспективах, так как они полстолетия широко используются в клинике. Первая их аллогенная трансплантация — 1964—68 годы, потом 90-й год — за это Нобелевская премия. Слава тебе господи, онкогематология, наследственные заболевания с гематологическим синдромом именно так и лечатся — гемопоэтическими клетками костного мозга и пуповинной крови, для восстановления повреждённого или уничтоженного кроветворения. И, в общем, вопросов к этому нет. Есть разные формы совершенствования этой методики, направленные на более эффективное подавление иммунной системы перед трансплантацией, методики обогащения трансплантата гемопоэтическими стволовыми клетками, подращивание этих клеток в условиях in vitro. Это всё есть, да, но концепция — вот она; и полстолетия работает.
Но если мы говорим о других видах стволовых клеток, то там ситуация иная, нельзя их всех рассматривать «в кучке». Поэтому, если Вы сможете сформулировать, какие стволовые клетки Вас интересуют, то постараюсь ответить.
XX2 ВЕК. Я не специалист, но знаю, что сейчас много говорят, например, о плюрипотентных стволовых клетках.
Р. Д. Вы имеете в виду iPS, да? Клетки с индуцированной плюрипотентностью. Если Вы обратили внимание, то даже начатые клинические исследования с применением этого материала посвящены лечению генетического заболевания (генетический дефект клеток пигментного эпителия сетчатки). Это та нозология, которая требует, с одной стороны — восполнения погибших или погибающих клеток того же организма, то есть они должны быть аутогенными, с другой стороны — клетки пациента должны быть генетически исправлены, доведены до этапа iPS лабораторным путём, затем их надлежит куда-то направить по пути дифференцировки, в данном случае в сторону пигментного эпителия. Но ведь ниша генетических болезней — это очень небольшая область медицины; редкие болезни. Это значит — экономические издержки от разработки таких методов могут быть столь велики и неокупаемы, что они могут стать фактором риска того, что собственно широкой трансляции в клиническую практику для рутинного применения не получится.
XX2 ВЕК. То есть, Вы думаете, что в это просто перестанут вкладываться?
Р. Д. Генетические болезни по-другому радикально не лечатся. Их нужно лечить путём исправления генов и эффективной доставки исправленного генетического материала. Здесь эта технология кажется — говорю осторожно — кажется действительно выигрышной в сравнении со всеми остальными возможностями. Пока особой альтернативы нет, кажется, что это должно срабатывать. Но каждый раз это будет индивидуальный и персонифицированный подход. И кто заплатит за такое лечение?
XX2 ВЕК. Нет альтернативы? А CRISPR/Cas9?
Р. Д. Да, но их доставить же надо по месту назначения. Вы его по вене-то не пустите. Это ж не препарат системного действия, их как таблетку не съешь и не пойдёшь дальше. Эти конструкции нужно как-то доставить в организм, в ткани и клетки. Элементарный пример — наследственная патология мышечной ткани миодистрофия Дюшенна, страшное заболевание. Берём CRISPR/Cas9, вы что его три раза в день после еды будете принимать по столовой ложке? Как вы его доставите в каждое мышечное волокно? У взрослого 40 кг мышечной ткани; ладно, у ребёнка пусть 10—15 кг. Как вы в эти сотни миллионов волокон, внутрь, поместите исправляющую мутацию конструкцию и исправите таким образом ген дистрофина? Мы сами это не сделаем, не сможем. Эту тонкую процедуру должны выполнить мобилизованные нами клетки-помощники. Пускай, это будут iPS, например, которые в исправленном виде можно трансплантировать, рассчитывая на то, что они донесут нужную информацию в нужное место, моделируя, заставляя/обучая их её доносить. Конечно, это вопрос технологии, как это реализовать. И здесь такая технология как раз абсолютно выигрышная, потому что пока не просматривается никаких альтернатив, которые могли бы её заменить.
XX2 ВЕК. Несколько лет назад в СМИ и соцсетях много говорили о том, что в дорогих клиниках, в которых лечатся богатые люди, всем подряд и от всего подряд колют стволовые клетки. Это о чём, о каких клетках? Что им кололи?
Р. Д. Предлагаю спросить прокуратуру об этом. Потому что, если всем подряд что-то кололи, предполагаю, что где-то в недрах прокуратуры должны храниться десятки томов уголовных дел. Вы слышали хоть об одном уголовном деле на эту тему?
XX2 ВЕК. Это какой-то развод был, видимо?
Р. Д. Не развод, но такая, жареная тема. Почему бы не написать об этом пару статей в каком-нибудь таблоиде. Прикольно же.
XX2 ВЕК. То есть, возможно, и не было ничего?
Р. Д. Знаете, конечно, недобросовестные люди есть в любом деле. Есть недобросовестные водители троллейбусов, наверное, есть недобросовестные работники завода, на котором делают ракеты. Наверняка есть и недобросовестные люди в белых халатах, никуда от этого не деться. Поэтому вполне допускаю, что в своё время существовали организации, которые этим занимались, но я вас уверяю: их никогда не существовало в таком количестве, как нам об этом говорили, в том числе и чиновники Минздрава. Я помню эти цитаты, мне приходилось присутствовать на разнообразных заседаниях, слушаниях, в Госдуме, чёрт-те где, где даже представители Минздрава, не буду называть фамилии, утверждали, что чуть ли не в каждом подвале колют плюрипотентные клетки. Конечно, такого не было, это всё чепуха. А отдельные факты если и были, то по ним должны были бы сохраниться материалы административных и уголовных расследований. Ну покажите.
XX2 ВЕК. Значит, если это было, это было скорее преступление?
Р. Д. Если там нарушено законодательство, то как это иначе квалифицировать? Было преступление или нет, может определить, наверное, суд, но, скажите — хоть что-то дошло до суда? Хоть одно вообще дело, хоть одно разбирательство было? Ребята, давайте оперировать фактами. Где? Кто? Когда?
Да, конечно, можно зайти в интернет, погуглить, и вы найдёте клинику в Швейцарии. Эта страна не входит в Евросоюз, поэтому там себе позволяют всякое. Они, допустим, лечат многие болезни, клиника Пауля Ниханса, клетками загадочной чёрной горной овцы. То есть, это использование ксеногенных клеток. У них даже русскоязычная страница есть. Вот, может, у них там в Швейцарии и нарушается закон…
XX2 ВЕК. Овцы?
Р. Д. Овцы. Чёрной, горной.
XX2 ВЕК. Как эти клетки-то вообще с человеческим организмом взаимодействуют?
Р. Д. Так, как и положено ксеногенным клеткам. Должны погибнуть. Должны вызвать какие-то гуморальные и иммунные реакции. Но опять же, он их 50 лет применял, Пауль Ниханс. Судя по тому, что пишут, многие известные люди были клиентами этой клиники, некоторые папы римские, Чарли Чаплин. Это всё вполне можно найти в доступных источниках на русском языке. И, в общем, клиника работает, насколько я понимаю вполне успешно.
XX2 ВЕК. Но это же шаманство? То же самое, что и, например, всякая парфюмерия, как бывает, знаете, на упаковке написано: «Крем со стволовыми клетками берёзы»? Только что не «стволовые клетки ствола берёзы».
Р. Д. Ну шаманство отчасти, да… Что касается косметических дел, это маркетинг. «Стволовые клетки берёзы», ну и ладно, мало ли что напишут. Что касается этой клиники, тут, шаманство не шаманство, нельзя сбрасывать со счетов некое неспецифическое воздействие на организм реципиента. Попадают чужеродные клетки, бодрится иммунная система, начинаются гормональные какие-то сдвиги, какой-то период это работает… Я предполагаю сейчас, я не утверждаю. Потому что у меня нет опыта исследований, я не видел ни одной публикации. Честно говоря, внимательно не смотрел, но вот так вот мне не попадалось за пятнадцать лет публикаций по системному введению ксеногенных клеток, от животных человеку. В моём представлении ничего хорошего от этого быть не должно. Но нельзя сбрасывать со счетов, ещё раз повторю, и какую-то неспецифическую реакцию организма, которая действительно может изменить в некоторых ситуациях статус организма, баланс болезни и здоровья. Насколько надолго, в какую сторону? Но опять же, мы же не видели, в общем, ни одного судебного разбирательства за эти несколько десятков лет.
XX2 ВЕК. Все довольны, видимо? Удивительно… Чёрт, вы так срезали, я так хотел поговорить о тканеинженерных органах…
Р. Д. Можем, конечно, пофантазировать на эту тему.
XX2 ВЕК. Но ведь постоянно появляются сообщения: вырастили то, вырастили сё, на каркас подсадили…
Р. Д. Ничего не вырастили. Никто ничего нигде не вырастил, понимаете? Дело ведь в том, что вы эти сообщения читаете в интерпретации пресс-служб университетов или русскоязычных журналистов, что ещё хуже. Я обезличенно говорю, но просто очень часто, когда повторяют/пересказывают одну и ту же новость через три колена, да ещё с нехорошим английским переводом, то конечный итог, публикуемый в России, радикально отличается от того, что было на самом деле. Поэтому не верьте просто тому, что слышите, вот и всё. Никакой орган ещё никто никогда нигде не вырастил. Как вырастит, отпразднуем, откупорим бутылочку шампанского.
XX2 ВЕК. Буквально на днях была новость о том, что выращен кишечник и даже с нервной тканью.
Р. Д. Вырастить орган можно только внутри организма. Его нельзя вырастить за пределами организма. Можно создать некий биоартифициальный эквивалент. Даже не аналог. Где будет неживая строма, то есть каркас, на который «село» клеток на два-три-четыре-пять порядков меньше, чем их на самом деле находится в единице объёма любой живой ткани. Эти клетки находятся в отрыве от нервной регуляции, в условиях in vitro — в отрыве от гуморальной регуляции, и не нужно фантазировать: они не «садятся» качественно на предлагаемый в качестве каркасов субстрат; они не выстраивают качественную ткань, этого ничего не происходит.
XX2 ВЕК. А что происходит?
Р. Д. В какой момент? В момент in vitro? Или в тот момент, когда их подсаживают в организм? In vitro ничего не происходит. Живут они и живут. Для них создаются условия, им тепло, влажно, кислород, витаминки — всё есть, они себе живут. Клетки можно культивировать на поверхности, в чашке, а можно в трёхмерной системе. Для этого, допустим, используются специальные мембраны, чтобы можно было увеличить площадь поверхности и можно было в одном флаконе выращивать больше клеток. Естественно, в условиях более интенсивного обмена среды и газов. А можно вместо этих сложных губчатых или мембранных фильтров, на которых выращивают большие объёмы клеток, предложить этим клеткам матрикс и сказать: «А это матрикс для тканевой инженерии». Суть не поменяется: некоторые клетки «садятся» и живут. Ну, может быть, некоторые размножаются, где-то что-то синтезируют. В итоге получается, что на трёхмерном неживом каркасе существует, иногда в полслоя, иногда в один слой, иногда в несколько слоёв, какое-то количество клеток. Как правило, это клетки соединительнотканной природы, как правило, для этого используют мультипотентные мезенхимальные стромальные клетки, те, которые мы называем ММСК, или, как иногда говорят, МСК, — ну и что?
Представьте, что есть такое медицинское изделие. Можно сверху наслоить эпителиальных клеток, тогда по поверхности поползёт какой-то эпителий. И замечательно, и это всё, что происходит in vitro. Да, ещё можно подействовать какими-то химическими или биологическими агентами и индуцировать направленную дифференцировку. Но не нужно думать, что будет расти кость, если мы направляем это в остеогенную сторону. Нет, там выпадут маленькие-маленькие крошечки минерала, кристаллики, которые видны только под микроскопом, микроскопические преципитаты фосфатов кальция. Будут так же минорные молекулярные признаки идущей костной дифференцировки. Вот что будет в подавляющем, абсолютном большинстве случаев и абсолютном числе таких технологий.
Что происходит при помещении такого изделия in vivo? Во-первых, как поместить его in vivo? Чаще всего это операция. Операция — это травма, это рана; на это организм реагирует воспалением, миграцией, агрессией лейкоцитов, оксидацией, выработкой провоспалительных цитокинов, то есть, добрая половина пересаженного материала погибает тут же. Дальше возникает вопрос кровоснабжения — они, ведь, кушать хотят. In vitro им богатую и дорогую питательную среду по трубочке подавали, а тут они попали в операционное ложе, даже сосудов нет. Если это орган, который должен перистальтировать, или сердце, то существенное значение имеет развитие ещё вегетативной нервной системы, интрамуральных нервных сплетений, должна произойти интеграция с системой нервной регуляции. Эти сказки, о том, что клетки такие умные и после пересадки сами знают, что делать, это всё мы уже проходили в 90-х годах и в начале 2000-х, в экспериментах, когда их просто вводили. Была такая мысль, что они сами придут по механизму хоуминга, по градиенту концентрации некоторых веществ в нужное место и там всё сделают… Да, действительно, этот эффект направленной миграции показан в огромном количестве статей, что по градиенту цитокинов клетки, даже после системного введения могут мигрировать туда, где им вкусно пахнет, где концентрация каких-то аттрактантов больше, единичные из них действительно могут во что-то дифференцироваться. Единичные! Как правило, на организменном уровне, в клинической картине заболеваний этот «приход» клеток вообще не сказывается. В основе этого лежит то, что после пересадки каких-то тканевых эквивалентов, даже в экспериментах на животных, если их проводить корректно, чаще всего происходит либо полная, тотальная гибель пересаженного клеточного материала, либо субтотальная.
Каким образом на это реагирует организм? Все наши патоморфологические реакции на такого рода вмешательства известны и стереотипны; и давным-давно описаны в учебниках: рассасывание, инкапсуляция, прорастание соединительной тканью, нагноение… Идеальный случай, когда процесс рассасывания пересаженного (имплантированного) материала происходит одновременно с замещением своими тканями с краёв раны (операционной раны).
Допустим, костные хирурги никогда не фантазируют на эту тему. Все разработчики костных материалов как раз эту цель и закладывают в идеологию своих разработок и честно об этом говорят: мы хотим создать такой материал, чтобы скорость его рассасывания соответствовала скорости роста рядом расположенной кости, чтобы процесс был уравновешен. Проблема в том, что пока химикам-технологам не удаётся это сделать, минерал слишком долго не рассасывается, подбирают комбинации — минерал, минерал плюс клетки — не для того, чтобы они стали какой-то выдающейся костью, а для того, чтобы они способствовали этому балансу скоростей обоих процессов.
В остальных областях хирургии пока ещё коллеги не готовы признаться (в первую очередь себе), что и в других тканях действует тот же принцип: все заплатки на пузыри, все заплатки на трубчатые органы (кишка) — это тоже рассасывание с замещением. Да, в отличие от синтетических материалов, которые для этого используются, в тканевой инженерии процесс может быть более точным, по скорости более синхронизированным, с одной стороны. С другой стороны, есть материалы биологического происхождения, они используются, они есть на рынке, имеются в виду разнообразные заплатки, получаемые из перикарда, из фасций и др., они применяются несколько десятков лет, чуть ли не столетие. Активно используются в хирургической практике, и замечательно, и хорошо. Конечно, есть какие-то случаи, где не получается, я не готов огульно распространить это на весь организм, есть сложные области, где пока это не получается сделать.
Если прорасти насквозь не удаётся, то вторая стереотипная реакция организма на пересадку тканеинженерной конструкции — это обойти препятствие, обрасти и инкапсулировать. Это следующий вариант: заключить в соединительнотканную капсулу. Поэтому, когда мы восстанавливаем какие-то тканевые элементы, части органов, где функционально ведущей тканью является эпителий, то при удачном стечении обстоятельств он просто растёт поверх, вот и всё. Это не те клетки, которые находились в этом биоартифициальном эквиваленте. Это свои клетки организма, это же не в вакууме всё происходит, вокруг конструкции всегда есть живые ткани.
Уверен, что для подавляющего большинства случаев тканевой инженерии, мы начнём скоро об этом говорить. Сейчас пока стесняемся. Регулярно посещаю все форумы, смотрю, слушаю. Десять лет уже мы об этом не говорим, но чувствуется, что пора. Пора раскрывать карты и переставать морочить голову.
Это не значит, что у этих технологий нет будущего или нет каких-то минорных аппликаций. Есть какие-то: есть пищевод, есть трахея; но, во-первых, это не значит, что и там нет альтернатив, они там есть. Да, тканевая инженерия — это интересный подход; можно поиграть, попробовать, посмотреть — в доклинических исследованиях, прежде всего. Но в принципе каких-то мощных аппликаций для тканевой инженерии я пока не вижу.
XX2 ВЕК. Выходит, ко всем сообщениям о том же выращенном кишечнике с нервной тканью, о том, что выращена искусственная вагина на некоем каркасе, стоит относиться как к пустому хвастовству?
Р. Д. Вот смотрите: берут каркас, сеют клетки там — гладкомышечные; получается трубка. Если её вшить на место удалённой или неразвившейся вагины, будет трубка, замещающая вагину. Можно сказать, что это вагина, что ли? Чем дольше эта трубка стоит на этом месте, тем интенсивнее в неё начинают прорастать нервы, нарастает соединительная ткань, нарастает свой эпителий — так это ж свои, это же не мы присадили и подшили нервы какие-то… Вагина, может, не самый удачный пример…
XX2 ВЕК. В пресс-релизе говорилось, что это для женщин с недоразвитием влагалища и что это довольно часто встречающаяся проблема.
Р. Д. Не часто, далеко не часто (1 случай на 5000—20000 девочек). Кроме того, пластические, реконструктивные хирурги делают вагины из фрагмента кишечника и из других собственных тканевых материалов. На сегодняшний день научились трансплантировать даже матку, более того — даже и рожать после этого. Поэтому, вагина, с точки зрения науки — интересно. С точки зрения практики — зачем?
XX2 ВЕК. Меня предупреждали, что вы скептик…
Р. Д. Но что настолько! (смеётся)
Это удивительно, на самом деле. Каждый раз, когда иду разговаривать с учёными, обычно настроен на что-то такое: «Давайте поговорим о будущем, о том, как всё будет прекрасно». Но нет. В противочумном говорят, что последние штаммы оспы никогда не уничтожат; Александр Каплан говорит, что мозг — слишком сложная материя, и мы никогда его не воспроизведём; Вы говорите, что тканеинженерных органов никогда не будет, — грустно.
Р. Д. Ну Вы же знаете: пессимист — это хорошо информированный оптимист.
XX2 ВЕК. Хотелось бы всё-таки светлых нот. А что хорошего происходит?
Р. Д. Да жить хорошо. Солнце светит. Небо голубое. Своим делом заниматься прекрасно. Больным помогать. Разрабатывать и внедрять новые методы — вообще великолепно.
XX2 ВЕК. И какие есть интересные новые методы в плане применения стволовых клеток?
Р. Д. Каких? Опять спрашиваю: каких? Я (это, опять же, субъективно) с большим интересом жду результатов именно по лечению генетических заболеваний с использованием технологии iPS. Это исследования, которые начались с замещения атрофированного пигментного эпителия в сетчатке. Чрезвычайно интересно. Здесь, как уже говорил, нет альтернативы, и мы впервые получили молекулярную отмычку для этой проблемы. Это может оказаться очень мощным прорывом. Да, таких больных немного. Но вчера они были приговорены, а сегодня появилась технология, дающая им свет. В большинстве других случаев такого критического перепада «вчера-сегодня» нет. Замещают трахею, но её и так замещали. Хуже или лучше — мы смотрим на статистику по результатам и не можем сказать, что предыдущие методы были сильно хуже тканеинженерных. А вот в случае сетчатки не было ничего вообще.
Вообще, когда происходит прогресс — это сразу видно. Например, технология iPS, первые работы — шестой год (2006), потом восьмой год, и, считайте, через шесть лет — Нобелевская премия! То есть, очевидно, что технология дала нам какой-то новый серьёзный инструмент. Не всегда так, конечно, происходит с Нобелевским комитетом, очень часто Нобелевский комитет консервативен, но, тем не менее, здесь это совершенно чётко видно. А вся эта чудесная тканевая инженерия… Ну, сколько ей? Ну, 20 лет? Где прорывы-то? Какую проблему решили за 20 лет?
XX2 ВЕК. А есть ещё такие вдохновляющие примеры? Когда вчера ничего, а сегодня прорыв?
Р. Д. ЭКО. Экстракорпоральное оплодотворение. До 78 года ничего, а с 78-го — пожалуйста.
XX2 ВЕК. А посвежее?
Р. Д. Посвежее, будьте любезны, CRISPR/Cas9. Этой технологии два-три года, на самом деле, именно в том варианте, в каком она есть сейчас. А уже начались клинические исследования, представляете?
XX2 ВЕК. В Китае уже пытаются…
Р. Д. Там даже да, уже коррекцию эмбриона делают.
XX2 ВЕК. Взрослого ракового больного ещё пытаются лечить с помощью CRISPR.
Р. Д. Прекрасно. Если получится — замечательно.
Появилась ещё усовершенствованная мощнейшая технология по обучению лимфоцитов, натаскиванию их на злокачественные опухоли. То, что мы не можем сделать другими способами, технология химерных антигенных рецепторов.
XX2 ВЕК. CAR-T?
Р. Д. Да, да. И тут же пошли клинические исследования. Вот это мощнейшие вещи, они всегда на стыке тончайшей прикладной молекулярной биологии и трансплантологии. А клетки на каркасах можно ещё 15 лет растить. Для студенческих работ вполне сгодится, ну для дипломных — интересно же.
XX2 ВЕК. Но ведь выращиванием тканеинженерных органов очень много лабораторий занимается по всему миру.
Р. Д. Ну и что?
XX2 ВЕК. Они все, все эти сотни, наверное, учёных занимаются чепухой?
Р. Д. Разные лаборатории работают с разной мотивацией. Кто-то сел на свой конёк, у кого-то это хорошо получается, гранты дают — ну грех не пользоваться. Наука — это такой же способ зарабатывания и приношения денег в семью. Кто-то действительно искренне полагает, что вот сейчас мы что-то вырастим и пришьём, и оно прирастёт. У кого-то не хватает фантазии придумать что-то другое. У кого-то опыта не хватает. Кто-то начальству хочет угодить. У всех разная мотивация.
XX2 ВЕК. Мне всё же хочется быть оптимистом. Не просто ведь засевают клетками. Появляются сообщения, что там прорастили сосуды, там прорастили нервную ткань…
Р. Д. Слышу такие сообщения десять лет; до некоторой степени я — в теме. Одиннадцать лет редактор профильного научного журнала, как вы знаете, и я это слышу все эти годы. Наверняка это всё и до меня ещё говорили, но я этого не слышал, потому что был маленький.
Ну, слушайте, сосуды растили в условиях in vitro от момента начала исследований in vitro, то бишь с начала XX века, когда уже системно начали культивировать ткани, например, соединительную ткань. Ну и росли там сосуды, почему бы им не расти? Сто лет они растут основные клетки сосудов — эндотелий, сто десять — если быть точным; они растут in vitro — и что?
Первая русская монография по культивированию соединительной ткани — одна тысяча девятьсот шестнадцатый год. Первый выпуск журнала, который называется «Русский архив анатомии, гистологии и эмбриологии». Издатель — профессор А. С. Догель, Петроградский уже, университет, но пока ещё Императорский. Монография профессора А. А. Максимова. И у него там это показано, и эндотелий показан…
XX2 ВЕК. И ожидания…
Р. Д. Ожидать — можно. Ждите.
XX2 ВЕК. А вот когда говорят о биоискусственных органах — это что-то другое? Тоже недавно были новости: биоискусственная селезёнка, биоискусственная печень…
Р. Д. Я не знаю. Это слово — «биоискусственный» — под ним можно подразумевать чёрт знает что. С этим надо разбираться, что имеется в виду.
Что касается селезёнки, понимаете, в чём дело… Вот смотрите, достаточно частая травма среди молодых слегка половозрелых ребят, особенно военнослужащих срочной службы — это отрыв селезёнки или разрыв капсулы селезёнки. В этих случаях приходится её удалять, потому что оставить или ушить опасно, чревато кровотечением. Архитектура селезёнки такова, что она состоит из трёх компонентов: каркас (так называемая строма), а дальше, в определённом трёхмерном порядке, лимфоциты, это клетки, которые не выстраивают какую-то системную ткань, они растут узелками, тут размножились — шарик, тут размножились — шарик, а всё остальное — это погибающие эритроциты. Просто мешок с погибающими эритроцитами. «Кладбищем эритроцитов» её из-за этого называют. Какой-то выдающейся 3D-структуры, от которой бы зависела функция, там нет. Что делали раньше старые мастера? Я уж не знаю, делают сейчас или нет. Считается, что селезёнка нужна в молодом возрасте — для становления лимфопоэза и так далее, и так далее. У человека старшей возрастной группы её просто убирают, просто вы-бра-сы-ва-ют. В тазик. А молодым людям стараются сохранить. Но просто оставить её нельзя и ушить тоже нельзя. Потому что это орган без чёткой внутренней структуры, его тут зашьёшь, а тут расползётся. Поэтому что делали? Брали кухонную тёрку, стерильную разумеется, брали селезёнку, натирали её, перетирали, прямо на операции, в фарш. Брали сальник, есть у нас такое образование в животе, тоненькая плёночка двухслойная, где висят жировые образования, делали из сальника в нескольких местах мешочки, просто нитку пропускали и, как кисет, затягивали — и внутрь этот фарш. Фарш стерилен. Там что? Мёртвые эритроциты, погибающие, и лимфоциты, которые постепенно там формировали новые маленькие селезёночки. В результате у парня была не одна большая селезёнка в левом подреберье, а десять маленьких селезёночек, и лимфоциты продолжали жить и выполнять свою функцию. Так что про селезёнку лучше даже не рассказывать. Селезёнка — это вообще лапша на уши про тканевую инженерию. Несерьёзно.
С печенью да, печень — сложный орган с точки зрения 3D-архитектуры. Чудовищно сложный. Потому что гепатоциты, клетки печени, так поляризованы нестандартно, что с одной стороны они должны вырабатывать желчь и выпускать её в желчный проток, с другой стороны осуществлять детоксикацию, с третьей стороны они должны синтезировать белки и выбрасывать их в кровь, всё это должно правильно кровоснабжаться, то есть очень сложная система ангиоархитектуры. Плюс ещё ко всему этому должна быть соединительная ткань, на которой вся эта сложная конструкция держится. Никто нигде никогда этого ещё не воспроизвёл и скорее всего не воспроизведёт. Вырастить слой гепатоцитов и назвать это искусственной печенью или вырастить гепатоциты на губке или на шариках и назвать это искусственной печенью или биоискусственной печенью — это не значит воспроизвести фрагмент органа, это неправда. Никто, нигде и никогда по технологии тканевой инженерии не сделал этого, и скорее всего не сделает.
XX2 ВЕК. Федеральный центр трансплантологии, который в районе «Октябрьского поля», пару лет назад ещё объявлял о создании биоискусственной печени.
Р. Д. А вы посмотрите повнимательнее, о чём они говорили. Они публикуют работы, как правило, про экстракорпоральную искусственную печень. Это гепатоциты, которые выполняют часть функций, находясь в специальных колонках за пределами организма. Это один вариант. Второй вариант, с которым они работали, это берётся строма, то есть, соединительнотканный каркас, и на него засеваются гепатоциты. Ну да, они могут жить в трёхмерном пространстве, но это же не значит, что они функционируют как печень, что они одним концом вырабатывают желчь, другим вырабатывают белки, третьим осуществляют детоксикацию. Да нет, конечно. Обыватели склонны верить тому, что слышим. Мы склонны думать, что если говорят про биоискусственную печень, то это, бац, килограмм такой, и её можно взять и пришить. А журналисты склонны не разбираться до конца, в том, что они слышат. А некоторые учёные склонны несколько преувеличивать. И так рождается миф. Это вам рецепт рождения мифа.
Даже организм не умеет нормально восстанавливать печень. Это сказки, что стоит отрезать и… Вот орёл прилетал, там, к Прометею и выклёвывал, а у того всё отрастало… Да, конечно, у грызунов она неплохо регенерирует, очень хорошо. С человеком так не получается. Вы отрежете кусок печени, и фактически ничего потом не произойдёт. Будет какая-то гипертрофия через какое-то время, небольшая гиперплазия, но в принципе ничего не произойдёт. Вспомните ситуацию с циррозом, когда часть гепатоцитов, часть печёночных долек погибает, на их месте начинают формироваться эпителиальные узлы, то есть, молодые гепатоциты или их предшественники, гипотетическая стволовая клетка печени, которую никто ещё пока не нашёл, не идентифицировал, может развиваться, но проблема в чём — формируются эти узлы молодых, новообразованных гепатоцитов, но даже внутри организма к ним не подводятся сосуды и из них не выходят желчные протоки. И эта катастрофа называется цирроз печени, от этого умирают. Потому что, хоть и есть гепатоциты, но функцию свою они при такой трёхмерной организации выполнить не могут. Ни тебе детоксикации, ни тебе белкового синтеза.
XX2 ВЕК. Картина всё грустнее и грустнее.
Р. Д. Пора. Пора ложку честности влить в эту бочку патоки, которую слышим уже больше десяти лет.
Поэтому ответ на Ваш вопрос пока не может быть однозначным. С точки зрения лабораторной части, да, наверное, страны Азии количеством побеждают, прежде всего, за счёт Китая. С точки зрения качества и выхода для медицины, пока преждевременно делать выводы об азиатском лидерстве в регенеративной медицине. Мы два-три года слышим мнения о том, что вот-вот китайское количество перейдёт в качество. Наверное, в технике это происходит, но в биотехе пока нет.
XX2 ВЕК. А в плане чего количество может перейти в качество? Чего ожидают от китайцев?
Р. Д. Да ничего особенного. Воспроизведения и быстрого проведения клинических исследований западных технологий.
XX2 ВЕК. Это всё?
Р. Д. Это моё оценочное суждение. Генную терапию не придумали в Китае, CRISPR/Cas9, коррекцию генома тоже не придумали в Китае. Когда китайская научная индустрия начнёт действительно генерировать технологии? Чёрт его знает. Пока не генерирует. Пока только заимствование и творческое развитие и переосмысление.
XX2 ВЕК. По-вашему, когда можно ожидать в России или даже в мире реально используемых тканеинженерных органов для лечения людей?
Р. Д. А зачем?
XX2 ВЕК. Что значит — «зачем»? Разве они не нужны?
Р. Д. Понимаете, у нас есть такой стереотип, что это очень нужно.
XX2 ВЕК. А разве нет? Не ждать донора…
Р. Д. Это всё красивые журналистские сказки, на самом деле. Они очень хороши для научпопа, очень неплохи для получения и реализации грантов, но для жизни, как показывает опыт, они далеки не то что от реализации, но даже от смысла этой реализации. Я здесь скептиком делаюсь.
Да, наверное, существуют единичные аппликации, где это имеет смысл, но я вообще не думаю, что человечество пойдёт этим путём. Это вечная журналистская весёлая история, которая берёт начало, мне кажется, из карикатур прошлого (если не позапрошлого) века, когда доктор приходит в аптеку и берёт с полки печень, почки, селезёнку… Это всё не технологично.
Мы с вами одинаково понимаем термин «тканевая инженерия»? Может быть, мы его понимаем по-разному? В классическом понимании, тканевая инженерия — это использование некоего матрикса, некое каркаса (скаффолда), синтетического или естественного, на который мы «посадили» клетки. И они, такие умные, «сели» туда, размножились и превратились в то, во что надо пациенту и врачу. Но мы же видим, что это не работает. Это не работает даже для таких качественно простых вещей, как костная ткань. Простых — насколько живая ткань вообще может быть простой. А уж для таких сложных, многокомпонентных структур как пищевод, трахея, лёгкое, печень — это вообще не путь. С научной точки зрения — это, конечно, интересное направление; а с практической — путь утилизации денежных знаков, не более того.
XX2 ВЕК. Но пытаются же в этом направлении что-то сделать. Вы считаете, что у всего этого будущего нет?
Р. Д. Много чего пытаются сделать, но это же не значит, что из этого всё получится. У подавляющего большинства разработок тканевой инженерии будущего, конечно, нет. Они будут вытеснены гораздо более эффективными и технологичными подходами ещё до момента фактического перехода в клиническую практику.
XX2 ВЕК. Например, какими?
Р. Д. Например, интересная технология, у всех на слуху, это, конечно, биопринтинг. Там катастрофическое количество проблем, и сейчас трудно делать прогнозы в этом плане, но в принципе она выглядит гораздо интереснее, чем тканевая инженерия. А то, что называется «дёшево и сердито» и что действительно позволяют биотехнологии — это, конечно, выращивание гуманизированных животных. Потому что это понятно и это относительно дёшево.
XX2 ВЕК. Гуманизированные животные — это животные, которым подсажены человеческие ткани?
Р. Д. В том числе. На самых ранних этапах эмбриогенеза. Впрочем, набирающие обороты технологии коррекции генома могут побороться с экспрессией антигенов. Вырастить свинью, с неиммуногенным подходящим по размеру сердцем, которое можно брать и трансплантировать, может оказаться гораздо дешевле, чем вырастить псевдосердце из псевдокардиомиоцитов на псевдокаркасе, активировать там псевдоэлектрическую систему электрического сопряжения для координированных сокращений этих псевдокардиомиоцитов; запустить туда псевдокоронарные сосуды, которые это всё будут кровоснабжать… Ещё раз говорю: это красиво для научной фантастики, это очень «прикольно» для научпопа и это недурно работало в прошлом десятилетии для получения грантов. Но к концу этого десятилетия на это даже гранты перестанут давать, потому что уже понятно, что это мыльный пузырь.
XX2 ВЕК. По-моему, пересадка свиного сердца человеку выглядит не менее фантастично.
Р. Д. Да нет, технологии есть, прототипы гуманизированных животных уже лет десять как существуют, над этими технологиями умные компании работают, доведут скоро, надеюсь.
XX2 ВЕК. И не будет отторгаться?
Р. Д. Вы у меня спрашиваете, как у бабушки Ванги. В теории, в идеологии этой технологии именно это свойство и заложено, иначе смысла не было бы. Любой организм животный — гораздо более дешёвый и гораздо более эффективный биореактор, чем все технологические навороты, которые используются, все эти ухищрения с наполовину промышленными, наполовину подвальной сборки биореакторами, всё это, к сожалению, и это тоже всего лишь личное оценочное суждение, не технологично. Это сиюминутно, для совершенно конкретных форм околонаучного бизнеса.
XX2 ВЕК. А какие в таком случае есть перспективные направления для использования стволовых клеток?
Р. Д. Мы всегда должны называть вещи своими именами. Вы о каких стволовых клетках спрашиваете? Потому что, например, есть гемопоэтические стволовые клетки, и мы не можем говорить о перспективах, так как они полстолетия широко используются в клинике. Первая их аллогенная трансплантация — 1964—68 годы, потом 90-й год — за это Нобелевская премия. Слава тебе господи, онкогематология, наследственные заболевания с гематологическим синдромом именно так и лечатся — гемопоэтическими клетками костного мозга и пуповинной крови, для восстановления повреждённого или уничтоженного кроветворения. И, в общем, вопросов к этому нет. Есть разные формы совершенствования этой методики, направленные на более эффективное подавление иммунной системы перед трансплантацией, методики обогащения трансплантата гемопоэтическими стволовыми клетками, подращивание этих клеток в условиях in vitro. Это всё есть, да, но концепция — вот она; и полстолетия работает.
Но если мы говорим о других видах стволовых клеток, то там ситуация иная, нельзя их всех рассматривать «в кучке». Поэтому, если Вы сможете сформулировать, какие стволовые клетки Вас интересуют, то постараюсь ответить.
XX2 ВЕК. Я не специалист, но знаю, что сейчас много говорят, например, о плюрипотентных стволовых клетках.
Р. Д. Вы имеете в виду iPS, да? Клетки с индуцированной плюрипотентностью. Если Вы обратили внимание, то даже начатые клинические исследования с применением этого материала посвящены лечению генетического заболевания (генетический дефект клеток пигментного эпителия сетчатки). Это та нозология, которая требует, с одной стороны — восполнения погибших или погибающих клеток того же организма, то есть они должны быть аутогенными, с другой стороны — клетки пациента должны быть генетически исправлены, доведены до этапа iPS лабораторным путём, затем их надлежит куда-то направить по пути дифференцировки, в данном случае в сторону пигментного эпителия. Но ведь ниша генетических болезней — это очень небольшая область медицины; редкие болезни. Это значит — экономические издержки от разработки таких методов могут быть столь велики и неокупаемы, что они могут стать фактором риска того, что собственно широкой трансляции в клиническую практику для рутинного применения не получится.
XX2 ВЕК. То есть, Вы думаете, что в это просто перестанут вкладываться?
Р. Д. Генетические болезни по-другому радикально не лечатся. Их нужно лечить путём исправления генов и эффективной доставки исправленного генетического материала. Здесь эта технология кажется — говорю осторожно — кажется действительно выигрышной в сравнении со всеми остальными возможностями. Пока особой альтернативы нет, кажется, что это должно срабатывать. Но каждый раз это будет индивидуальный и персонифицированный подход. И кто заплатит за такое лечение?
XX2 ВЕК. Нет альтернативы? А CRISPR/Cas9?
Р. Д. Да, но их доставить же надо по месту назначения. Вы его по вене-то не пустите. Это ж не препарат системного действия, их как таблетку не съешь и не пойдёшь дальше. Эти конструкции нужно как-то доставить в организм, в ткани и клетки. Элементарный пример — наследственная патология мышечной ткани миодистрофия Дюшенна, страшное заболевание. Берём CRISPR/Cas9, вы что его три раза в день после еды будете принимать по столовой ложке? Как вы его доставите в каждое мышечное волокно? У взрослого 40 кг мышечной ткани; ладно, у ребёнка пусть 10—15 кг. Как вы в эти сотни миллионов волокон, внутрь, поместите исправляющую мутацию конструкцию и исправите таким образом ген дистрофина? Мы сами это не сделаем, не сможем. Эту тонкую процедуру должны выполнить мобилизованные нами клетки-помощники. Пускай, это будут iPS, например, которые в исправленном виде можно трансплантировать, рассчитывая на то, что они донесут нужную информацию в нужное место, моделируя, заставляя/обучая их её доносить. Конечно, это вопрос технологии, как это реализовать. И здесь такая технология как раз абсолютно выигрышная, потому что пока не просматривается никаких альтернатив, которые могли бы её заменить.
XX2 ВЕК. Несколько лет назад в СМИ и соцсетях много говорили о том, что в дорогих клиниках, в которых лечатся богатые люди, всем подряд и от всего подряд колют стволовые клетки. Это о чём, о каких клетках? Что им кололи?
Р. Д. Предлагаю спросить прокуратуру об этом. Потому что, если всем подряд что-то кололи, предполагаю, что где-то в недрах прокуратуры должны храниться десятки томов уголовных дел. Вы слышали хоть об одном уголовном деле на эту тему?
XX2 ВЕК. Это какой-то развод был, видимо?
Р. Д. Не развод, но такая, жареная тема. Почему бы не написать об этом пару статей в каком-нибудь таблоиде. Прикольно же.
XX2 ВЕК. То есть, возможно, и не было ничего?
Р. Д. Знаете, конечно, недобросовестные люди есть в любом деле. Есть недобросовестные водители троллейбусов, наверное, есть недобросовестные работники завода, на котором делают ракеты. Наверняка есть и недобросовестные люди в белых халатах, никуда от этого не деться. Поэтому вполне допускаю, что в своё время существовали организации, которые этим занимались, но я вас уверяю: их никогда не существовало в таком количестве, как нам об этом говорили, в том числе и чиновники Минздрава. Я помню эти цитаты, мне приходилось присутствовать на разнообразных заседаниях, слушаниях, в Госдуме, чёрт-те где, где даже представители Минздрава, не буду называть фамилии, утверждали, что чуть ли не в каждом подвале колют плюрипотентные клетки. Конечно, такого не было, это всё чепуха. А отдельные факты если и были, то по ним должны были бы сохраниться материалы административных и уголовных расследований. Ну покажите.
XX2 ВЕК. Значит, если это было, это было скорее преступление?
Р. Д. Если там нарушено законодательство, то как это иначе квалифицировать? Было преступление или нет, может определить, наверное, суд, но, скажите — хоть что-то дошло до суда? Хоть одно вообще дело, хоть одно разбирательство было? Ребята, давайте оперировать фактами. Где? Кто? Когда?
Да, конечно, можно зайти в интернет, погуглить, и вы найдёте клинику в Швейцарии. Эта страна не входит в Евросоюз, поэтому там себе позволяют всякое. Они, допустим, лечат многие болезни, клиника Пауля Ниханса, клетками загадочной чёрной горной овцы. То есть, это использование ксеногенных клеток. У них даже русскоязычная страница есть. Вот, может, у них там в Швейцарии и нарушается закон…
XX2 ВЕК. Овцы?
Р. Д. Овцы. Чёрной, горной.
XX2 ВЕК. Как эти клетки-то вообще с человеческим организмом взаимодействуют?
Р. Д. Так, как и положено ксеногенным клеткам. Должны погибнуть. Должны вызвать какие-то гуморальные и иммунные реакции. Но опять же, он их 50 лет применял, Пауль Ниханс. Судя по тому, что пишут, многие известные люди были клиентами этой клиники, некоторые папы римские, Чарли Чаплин. Это всё вполне можно найти в доступных источниках на русском языке. И, в общем, клиника работает, насколько я понимаю вполне успешно.
XX2 ВЕК. Но это же шаманство? То же самое, что и, например, всякая парфюмерия, как бывает, знаете, на упаковке написано: «Крем со стволовыми клетками берёзы»? Только что не «стволовые клетки ствола берёзы».
Р. Д. Ну шаманство отчасти, да… Что касается косметических дел, это маркетинг. «Стволовые клетки берёзы», ну и ладно, мало ли что напишут. Что касается этой клиники, тут, шаманство не шаманство, нельзя сбрасывать со счетов некое неспецифическое воздействие на организм реципиента. Попадают чужеродные клетки, бодрится иммунная система, начинаются гормональные какие-то сдвиги, какой-то период это работает… Я предполагаю сейчас, я не утверждаю. Потому что у меня нет опыта исследований, я не видел ни одной публикации. Честно говоря, внимательно не смотрел, но вот так вот мне не попадалось за пятнадцать лет публикаций по системному введению ксеногенных клеток, от животных человеку. В моём представлении ничего хорошего от этого быть не должно. Но нельзя сбрасывать со счетов, ещё раз повторю, и какую-то неспецифическую реакцию организма, которая действительно может изменить в некоторых ситуациях статус организма, баланс болезни и здоровья. Насколько надолго, в какую сторону? Но опять же, мы же не видели, в общем, ни одного судебного разбирательства за эти несколько десятков лет.
XX2 ВЕК. Все довольны, видимо? Удивительно… Чёрт, вы так срезали, я так хотел поговорить о тканеинженерных органах…
Р. Д. Можем, конечно, пофантазировать на эту тему.
XX2 ВЕК. Но ведь постоянно появляются сообщения: вырастили то, вырастили сё, на каркас подсадили…
Р. Д. Ничего не вырастили. Никто ничего нигде не вырастил, понимаете? Дело ведь в том, что вы эти сообщения читаете в интерпретации пресс-служб университетов или русскоязычных журналистов, что ещё хуже. Я обезличенно говорю, но просто очень часто, когда повторяют/пересказывают одну и ту же новость через три колена, да ещё с нехорошим английским переводом, то конечный итог, публикуемый в России, радикально отличается от того, что было на самом деле. Поэтому не верьте просто тому, что слышите, вот и всё. Никакой орган ещё никто никогда нигде не вырастил. Как вырастит, отпразднуем, откупорим бутылочку шампанского.
XX2 ВЕК. Буквально на днях была новость о том, что выращен кишечник и даже с нервной тканью.
Р. Д. Вырастить орган можно только внутри организма. Его нельзя вырастить за пределами организма. Можно создать некий биоартифициальный эквивалент. Даже не аналог. Где будет неживая строма, то есть каркас, на который «село» клеток на два-три-четыре-пять порядков меньше, чем их на самом деле находится в единице объёма любой живой ткани. Эти клетки находятся в отрыве от нервной регуляции, в условиях in vitro — в отрыве от гуморальной регуляции, и не нужно фантазировать: они не «садятся» качественно на предлагаемый в качестве каркасов субстрат; они не выстраивают качественную ткань, этого ничего не происходит.
XX2 ВЕК. А что происходит?
Р. Д. В какой момент? В момент in vitro? Или в тот момент, когда их подсаживают в организм? In vitro ничего не происходит. Живут они и живут. Для них создаются условия, им тепло, влажно, кислород, витаминки — всё есть, они себе живут. Клетки можно культивировать на поверхности, в чашке, а можно в трёхмерной системе. Для этого, допустим, используются специальные мембраны, чтобы можно было увеличить площадь поверхности и можно было в одном флаконе выращивать больше клеток. Естественно, в условиях более интенсивного обмена среды и газов. А можно вместо этих сложных губчатых или мембранных фильтров, на которых выращивают большие объёмы клеток, предложить этим клеткам матрикс и сказать: «А это матрикс для тканевой инженерии». Суть не поменяется: некоторые клетки «садятся» и живут. Ну, может быть, некоторые размножаются, где-то что-то синтезируют. В итоге получается, что на трёхмерном неживом каркасе существует, иногда в полслоя, иногда в один слой, иногда в несколько слоёв, какое-то количество клеток. Как правило, это клетки соединительнотканной природы, как правило, для этого используют мультипотентные мезенхимальные стромальные клетки, те, которые мы называем ММСК, или, как иногда говорят, МСК, — ну и что?
Представьте, что есть такое медицинское изделие. Можно сверху наслоить эпителиальных клеток, тогда по поверхности поползёт какой-то эпителий. И замечательно, и это всё, что происходит in vitro. Да, ещё можно подействовать какими-то химическими или биологическими агентами и индуцировать направленную дифференцировку. Но не нужно думать, что будет расти кость, если мы направляем это в остеогенную сторону. Нет, там выпадут маленькие-маленькие крошечки минерала, кристаллики, которые видны только под микроскопом, микроскопические преципитаты фосфатов кальция. Будут так же минорные молекулярные признаки идущей костной дифференцировки. Вот что будет в подавляющем, абсолютном большинстве случаев и абсолютном числе таких технологий.
Что происходит при помещении такого изделия in vivo? Во-первых, как поместить его in vivo? Чаще всего это операция. Операция — это травма, это рана; на это организм реагирует воспалением, миграцией, агрессией лейкоцитов, оксидацией, выработкой провоспалительных цитокинов, то есть, добрая половина пересаженного материала погибает тут же. Дальше возникает вопрос кровоснабжения — они, ведь, кушать хотят. In vitro им богатую и дорогую питательную среду по трубочке подавали, а тут они попали в операционное ложе, даже сосудов нет. Если это орган, который должен перистальтировать, или сердце, то существенное значение имеет развитие ещё вегетативной нервной системы, интрамуральных нервных сплетений, должна произойти интеграция с системой нервной регуляции. Эти сказки, о том, что клетки такие умные и после пересадки сами знают, что делать, это всё мы уже проходили в 90-х годах и в начале 2000-х, в экспериментах, когда их просто вводили. Была такая мысль, что они сами придут по механизму хоуминга, по градиенту концентрации некоторых веществ в нужное место и там всё сделают… Да, действительно, этот эффект направленной миграции показан в огромном количестве статей, что по градиенту цитокинов клетки, даже после системного введения могут мигрировать туда, где им вкусно пахнет, где концентрация каких-то аттрактантов больше, единичные из них действительно могут во что-то дифференцироваться. Единичные! Как правило, на организменном уровне, в клинической картине заболеваний этот «приход» клеток вообще не сказывается. В основе этого лежит то, что после пересадки каких-то тканевых эквивалентов, даже в экспериментах на животных, если их проводить корректно, чаще всего происходит либо полная, тотальная гибель пересаженного клеточного материала, либо субтотальная.
Каким образом на это реагирует организм? Все наши патоморфологические реакции на такого рода вмешательства известны и стереотипны; и давным-давно описаны в учебниках: рассасывание, инкапсуляция, прорастание соединительной тканью, нагноение… Идеальный случай, когда процесс рассасывания пересаженного (имплантированного) материала происходит одновременно с замещением своими тканями с краёв раны (операционной раны).
Допустим, костные хирурги никогда не фантазируют на эту тему. Все разработчики костных материалов как раз эту цель и закладывают в идеологию своих разработок и честно об этом говорят: мы хотим создать такой материал, чтобы скорость его рассасывания соответствовала скорости роста рядом расположенной кости, чтобы процесс был уравновешен. Проблема в том, что пока химикам-технологам не удаётся это сделать, минерал слишком долго не рассасывается, подбирают комбинации — минерал, минерал плюс клетки — не для того, чтобы они стали какой-то выдающейся костью, а для того, чтобы они способствовали этому балансу скоростей обоих процессов.
В остальных областях хирургии пока ещё коллеги не готовы признаться (в первую очередь себе), что и в других тканях действует тот же принцип: все заплатки на пузыри, все заплатки на трубчатые органы (кишка) — это тоже рассасывание с замещением. Да, в отличие от синтетических материалов, которые для этого используются, в тканевой инженерии процесс может быть более точным, по скорости более синхронизированным, с одной стороны. С другой стороны, есть материалы биологического происхождения, они используются, они есть на рынке, имеются в виду разнообразные заплатки, получаемые из перикарда, из фасций и др., они применяются несколько десятков лет, чуть ли не столетие. Активно используются в хирургической практике, и замечательно, и хорошо. Конечно, есть какие-то случаи, где не получается, я не готов огульно распространить это на весь организм, есть сложные области, где пока это не получается сделать.
Если прорасти насквозь не удаётся, то вторая стереотипная реакция организма на пересадку тканеинженерной конструкции — это обойти препятствие, обрасти и инкапсулировать. Это следующий вариант: заключить в соединительнотканную капсулу. Поэтому, когда мы восстанавливаем какие-то тканевые элементы, части органов, где функционально ведущей тканью является эпителий, то при удачном стечении обстоятельств он просто растёт поверх, вот и всё. Это не те клетки, которые находились в этом биоартифициальном эквиваленте. Это свои клетки организма, это же не в вакууме всё происходит, вокруг конструкции всегда есть живые ткани.
Уверен, что для подавляющего большинства случаев тканевой инженерии, мы начнём скоро об этом говорить. Сейчас пока стесняемся. Регулярно посещаю все форумы, смотрю, слушаю. Десять лет уже мы об этом не говорим, но чувствуется, что пора. Пора раскрывать карты и переставать морочить голову.
Это не значит, что у этих технологий нет будущего или нет каких-то минорных аппликаций. Есть какие-то: есть пищевод, есть трахея; но, во-первых, это не значит, что и там нет альтернатив, они там есть. Да, тканевая инженерия — это интересный подход; можно поиграть, попробовать, посмотреть — в доклинических исследованиях, прежде всего. Но в принципе каких-то мощных аппликаций для тканевой инженерии я пока не вижу.
XX2 ВЕК. Выходит, ко всем сообщениям о том же выращенном кишечнике с нервной тканью, о том, что выращена искусственная вагина на некоем каркасе, стоит относиться как к пустому хвастовству?
Р. Д. Вот смотрите: берут каркас, сеют клетки там — гладкомышечные; получается трубка. Если её вшить на место удалённой или неразвившейся вагины, будет трубка, замещающая вагину. Можно сказать, что это вагина, что ли? Чем дольше эта трубка стоит на этом месте, тем интенсивнее в неё начинают прорастать нервы, нарастает соединительная ткань, нарастает свой эпителий — так это ж свои, это же не мы присадили и подшили нервы какие-то… Вагина, может, не самый удачный пример…
XX2 ВЕК. В пресс-релизе говорилось, что это для женщин с недоразвитием влагалища и что это довольно часто встречающаяся проблема.
Р. Д. Не часто, далеко не часто (1 случай на 5000—20000 девочек). Кроме того, пластические, реконструктивные хирурги делают вагины из фрагмента кишечника и из других собственных тканевых материалов. На сегодняшний день научились трансплантировать даже матку, более того — даже и рожать после этого. Поэтому, вагина, с точки зрения науки — интересно. С точки зрения практики — зачем?
XX2 ВЕК. Меня предупреждали, что вы скептик…
Р. Д. Но что настолько! (смеётся)
Это удивительно, на самом деле. Каждый раз, когда иду разговаривать с учёными, обычно настроен на что-то такое: «Давайте поговорим о будущем, о том, как всё будет прекрасно». Но нет. В противочумном говорят, что последние штаммы оспы никогда не уничтожат; Александр Каплан говорит, что мозг — слишком сложная материя, и мы никогда его не воспроизведём; Вы говорите, что тканеинженерных органов никогда не будет, — грустно.
Р. Д. Ну Вы же знаете: пессимист — это хорошо информированный оптимист.
XX2 ВЕК. Хотелось бы всё-таки светлых нот. А что хорошего происходит?
Р. Д. Да жить хорошо. Солнце светит. Небо голубое. Своим делом заниматься прекрасно. Больным помогать. Разрабатывать и внедрять новые методы — вообще великолепно.
XX2 ВЕК. И какие есть интересные новые методы в плане применения стволовых клеток?
Р. Д. Каких? Опять спрашиваю: каких? Я (это, опять же, субъективно) с большим интересом жду результатов именно по лечению генетических заболеваний с использованием технологии iPS. Это исследования, которые начались с замещения атрофированного пигментного эпителия в сетчатке. Чрезвычайно интересно. Здесь, как уже говорил, нет альтернативы, и мы впервые получили молекулярную отмычку для этой проблемы. Это может оказаться очень мощным прорывом. Да, таких больных немного. Но вчера они были приговорены, а сегодня появилась технология, дающая им свет. В большинстве других случаев такого критического перепада «вчера-сегодня» нет. Замещают трахею, но её и так замещали. Хуже или лучше — мы смотрим на статистику по результатам и не можем сказать, что предыдущие методы были сильно хуже тканеинженерных. А вот в случае сетчатки не было ничего вообще.
Вообще, когда происходит прогресс — это сразу видно. Например, технология iPS, первые работы — шестой год (2006), потом восьмой год, и, считайте, через шесть лет — Нобелевская премия! То есть, очевидно, что технология дала нам какой-то новый серьёзный инструмент. Не всегда так, конечно, происходит с Нобелевским комитетом, очень часто Нобелевский комитет консервативен, но, тем не менее, здесь это совершенно чётко видно. А вся эта чудесная тканевая инженерия… Ну, сколько ей? Ну, 20 лет? Где прорывы-то? Какую проблему решили за 20 лет?
XX2 ВЕК. А есть ещё такие вдохновляющие примеры? Когда вчера ничего, а сегодня прорыв?
Р. Д. ЭКО. Экстракорпоральное оплодотворение. До 78 года ничего, а с 78-го — пожалуйста.
XX2 ВЕК. А посвежее?
Р. Д. Посвежее, будьте любезны, CRISPR/Cas9. Этой технологии два-три года, на самом деле, именно в том варианте, в каком она есть сейчас. А уже начались клинические исследования, представляете?
XX2 ВЕК. В Китае уже пытаются…
Р. Д. Там даже да, уже коррекцию эмбриона делают.
XX2 ВЕК. Взрослого ракового больного ещё пытаются лечить с помощью CRISPR.
Р. Д. Прекрасно. Если получится — замечательно.
Появилась ещё усовершенствованная мощнейшая технология по обучению лимфоцитов, натаскиванию их на злокачественные опухоли. То, что мы не можем сделать другими способами, технология химерных антигенных рецепторов.
XX2 ВЕК. CAR-T?
Р. Д. Да, да. И тут же пошли клинические исследования. Вот это мощнейшие вещи, они всегда на стыке тончайшей прикладной молекулярной биологии и трансплантологии. А клетки на каркасах можно ещё 15 лет растить. Для студенческих работ вполне сгодится, ну для дипломных — интересно же.
XX2 ВЕК. Но ведь выращиванием тканеинженерных органов очень много лабораторий занимается по всему миру.
Р. Д. Ну и что?
XX2 ВЕК. Они все, все эти сотни, наверное, учёных занимаются чепухой?
Р. Д. Разные лаборатории работают с разной мотивацией. Кто-то сел на свой конёк, у кого-то это хорошо получается, гранты дают — ну грех не пользоваться. Наука — это такой же способ зарабатывания и приношения денег в семью. Кто-то действительно искренне полагает, что вот сейчас мы что-то вырастим и пришьём, и оно прирастёт. У кого-то не хватает фантазии придумать что-то другое. У кого-то опыта не хватает. Кто-то начальству хочет угодить. У всех разная мотивация.
XX2 ВЕК. Мне всё же хочется быть оптимистом. Не просто ведь засевают клетками. Появляются сообщения, что там прорастили сосуды, там прорастили нервную ткань…
Р. Д. Слышу такие сообщения десять лет; до некоторой степени я — в теме. Одиннадцать лет редактор профильного научного журнала, как вы знаете, и я это слышу все эти годы. Наверняка это всё и до меня ещё говорили, но я этого не слышал, потому что был маленький.
Ну, слушайте, сосуды растили в условиях in vitro от момента начала исследований in vitro, то бишь с начала XX века, когда уже системно начали культивировать ткани, например, соединительную ткань. Ну и росли там сосуды, почему бы им не расти? Сто лет они растут основные клетки сосудов — эндотелий, сто десять — если быть точным; они растут in vitro — и что?
Первая русская монография по культивированию соединительной ткани — одна тысяча девятьсот шестнадцатый год. Первый выпуск журнала, который называется «Русский архив анатомии, гистологии и эмбриологии». Издатель — профессор А. С. Догель, Петроградский уже, университет, но пока ещё Императорский. Монография профессора А. А. Максимова. И у него там это показано, и эндотелий показан…
XX2 ВЕК. И ожидания…
Р. Д. Ожидать — можно. Ждите.
XX2 ВЕК. А вот когда говорят о биоискусственных органах — это что-то другое? Тоже недавно были новости: биоискусственная селезёнка, биоискусственная печень…
Р. Д. Я не знаю. Это слово — «биоискусственный» — под ним можно подразумевать чёрт знает что. С этим надо разбираться, что имеется в виду.
Что касается селезёнки, понимаете, в чём дело… Вот смотрите, достаточно частая травма среди молодых слегка половозрелых ребят, особенно военнослужащих срочной службы — это отрыв селезёнки или разрыв капсулы селезёнки. В этих случаях приходится её удалять, потому что оставить или ушить опасно, чревато кровотечением. Архитектура селезёнки такова, что она состоит из трёх компонентов: каркас (так называемая строма), а дальше, в определённом трёхмерном порядке, лимфоциты, это клетки, которые не выстраивают какую-то системную ткань, они растут узелками, тут размножились — шарик, тут размножились — шарик, а всё остальное — это погибающие эритроциты. Просто мешок с погибающими эритроцитами. «Кладбищем эритроцитов» её из-за этого называют. Какой-то выдающейся 3D-структуры, от которой бы зависела функция, там нет. Что делали раньше старые мастера? Я уж не знаю, делают сейчас или нет. Считается, что селезёнка нужна в молодом возрасте — для становления лимфопоэза и так далее, и так далее. У человека старшей возрастной группы её просто убирают, просто вы-бра-сы-ва-ют. В тазик. А молодым людям стараются сохранить. Но просто оставить её нельзя и ушить тоже нельзя. Потому что это орган без чёткой внутренней структуры, его тут зашьёшь, а тут расползётся. Поэтому что делали? Брали кухонную тёрку, стерильную разумеется, брали селезёнку, натирали её, перетирали, прямо на операции, в фарш. Брали сальник, есть у нас такое образование в животе, тоненькая плёночка двухслойная, где висят жировые образования, делали из сальника в нескольких местах мешочки, просто нитку пропускали и, как кисет, затягивали — и внутрь этот фарш. Фарш стерилен. Там что? Мёртвые эритроциты, погибающие, и лимфоциты, которые постепенно там формировали новые маленькие селезёночки. В результате у парня была не одна большая селезёнка в левом подреберье, а десять маленьких селезёночек, и лимфоциты продолжали жить и выполнять свою функцию. Так что про селезёнку лучше даже не рассказывать. Селезёнка — это вообще лапша на уши про тканевую инженерию. Несерьёзно.
С печенью да, печень — сложный орган с точки зрения 3D-архитектуры. Чудовищно сложный. Потому что гепатоциты, клетки печени, так поляризованы нестандартно, что с одной стороны они должны вырабатывать желчь и выпускать её в желчный проток, с другой стороны осуществлять детоксикацию, с третьей стороны они должны синтезировать белки и выбрасывать их в кровь, всё это должно правильно кровоснабжаться, то есть очень сложная система ангиоархитектуры. Плюс ещё ко всему этому должна быть соединительная ткань, на которой вся эта сложная конструкция держится. Никто нигде никогда этого ещё не воспроизвёл и скорее всего не воспроизведёт. Вырастить слой гепатоцитов и назвать это искусственной печенью или вырастить гепатоциты на губке или на шариках и назвать это искусственной печенью или биоискусственной печенью — это не значит воспроизвести фрагмент органа, это неправда. Никто, нигде и никогда по технологии тканевой инженерии не сделал этого, и скорее всего не сделает.
XX2 ВЕК. Федеральный центр трансплантологии, который в районе «Октябрьского поля», пару лет назад ещё объявлял о создании биоискусственной печени.
Р. Д. А вы посмотрите повнимательнее, о чём они говорили. Они публикуют работы, как правило, про экстракорпоральную искусственную печень. Это гепатоциты, которые выполняют часть функций, находясь в специальных колонках за пределами организма. Это один вариант. Второй вариант, с которым они работали, это берётся строма, то есть, соединительнотканный каркас, и на него засеваются гепатоциты. Ну да, они могут жить в трёхмерном пространстве, но это же не значит, что они функционируют как печень, что они одним концом вырабатывают желчь, другим вырабатывают белки, третьим осуществляют детоксикацию. Да нет, конечно. Обыватели склонны верить тому, что слышим. Мы склонны думать, что если говорят про биоискусственную печень, то это, бац, килограмм такой, и её можно взять и пришить. А журналисты склонны не разбираться до конца, в том, что они слышат. А некоторые учёные склонны несколько преувеличивать. И так рождается миф. Это вам рецепт рождения мифа.
Даже организм не умеет нормально восстанавливать печень. Это сказки, что стоит отрезать и… Вот орёл прилетал, там, к Прометею и выклёвывал, а у того всё отрастало… Да, конечно, у грызунов она неплохо регенерирует, очень хорошо. С человеком так не получается. Вы отрежете кусок печени, и фактически ничего потом не произойдёт. Будет какая-то гипертрофия через какое-то время, небольшая гиперплазия, но в принципе ничего не произойдёт. Вспомните ситуацию с циррозом, когда часть гепатоцитов, часть печёночных долек погибает, на их месте начинают формироваться эпителиальные узлы, то есть, молодые гепатоциты или их предшественники, гипотетическая стволовая клетка печени, которую никто ещё пока не нашёл, не идентифицировал, может развиваться, но проблема в чём — формируются эти узлы молодых, новообразованных гепатоцитов, но даже внутри организма к ним не подводятся сосуды и из них не выходят желчные протоки. И эта катастрофа называется цирроз печени, от этого умирают. Потому что, хоть и есть гепатоциты, но функцию свою они при такой трёхмерной организации выполнить не могут. Ни тебе детоксикации, ни тебе белкового синтеза.
XX2 ВЕК. Картина всё грустнее и грустнее.
Р. Д. Пора. Пора ложку честности влить в эту бочку патоки, которую слышим уже больше десяти лет.