Плоскоклеточный рак
Плоскоклеточный рак кожи часто встречающейся злокачественная опухоль поражающая любой участок кожи человеческого тела. Болезнь чаще всего локализуется на открытых для солнца участках кожи. Рак кожи может возникнуть в зонах хронического воспаления, длительно существующих ран и язв, так же на фоне рубцов.
Среди злокачественных новообразований кожи чаще всего встречаются опухоли эпителиального происхождения, из которых около 20% — случаи плоскоклеточного.
Как правило, это одиночное образование в виде эритематозных папул, атрофичных бляшек или узлов. На поверхности может наблюдаться шелушение кожи, иногда кровь. Кожа вокруг опухоли не изменена.
Опухоль чаще всего располагается на открытых участках тела, на лице, конечностях и туловище, а также на наружных половых органах, около заднего прохода и на тыльной стороне кисти. Излюбленная локализация поражения : 55% случаях болезнь поражает кожу головы и лица, 18% — заднюю поверхность кистей, 13% — ног.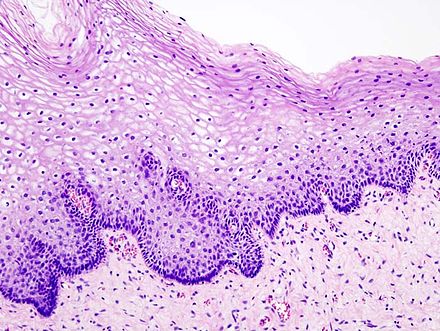
Факторы риска
- длительная воздействие УФ (солнце) — длительное, суммарно значительное на протяжении всей жизни, пребывание на солнце, перенесенные солнечные ожоги
- PUVA воздействие
- Ионизирующая радиация – лечение в анамнезе акне, псориаза, злокачественных новообразований
- Возраст старше 65 лет
- различные хронические заболевания и поражения кожи: в том числе предраковые заболевания, рубцы, язвы,
- иммуносупрессия (вирусная инфекция, трансплантация органов, )
- хроническое воспаление кожи
- химические агенты (Арсений, родон, селен и тд)
- генетические нарущения и предпосылки (УФ индуцированное нарушение p53, нарушения в работе киназной пути RAS)
- папилломовирусная инфекция: вирус папилломы человека типов 16, 18, 31, 33, 35 и 45 вызывает плоскоклеточный рак наружных половых органов, заднего прохода.
- Фоновые заболевание – пигментная ксеродерма, буллозный эпидермолиз, альбинизм.
- Некоторые лекарственные препараты – длительное использование вориконазола, некоторых фотосенсибилизирующие препараты
Клинические проявления заболевания
Рак in situ – болезнь Боуэна
Выделяют две формы роста плоскоклеточного рака кожи.
Язвенно инфильтративная (эндофитная) в начале представляет собой пятно, которое за несколько месяцев превращается в плотный малоподвижный узел. Через 4-6 месяцев на поверхности узла в центре образуется неправильной формы язва, иногда с неприятным запахом. Эта форма рака кожи быстро распространяется на окружающие ткани, поражает близлежащие (регионарные) лимфатические узлы, метастазирует в легкие и кости и часто рецидивирует.
Папиллярная или экзофитная форма роста. Характеризуется быстрым ростом первичного образования. Опухоль темно-красного или коричневого цвета возвышается над кожей, имеет вид «цветной капусты». Основание опухоли малоподвижное, за счет прорастания в глубокие слои кожи или окружающие ткани. В этих случаях характер агрессивности роста зависит от степени дифференцировки опухоли
Отдельно выделяют редкие формы плоскоклеточного рака
- поражение ротовой полости (болезнь возникает на фоне эритроплакии или лейкоплакии у людей злоупотребляющих табаком и алкоголем.

- Кератоакантома – благоприятный вариант высокодиференцированного рака кожи.
- веррукозная форма роста опухоли. Такое образование чаще всего красно-коричневого цвета, бугристое и покрытое коркой с похожими на бородавки разрастаниями. Для этого вида рака характерен медленный рост и редкое метастазирование. В пожилом возрасте веррукозная форма может походить на так называемый кожный рог. Локализуется в полости рта, вокруг ануса и наружных половых органов и на коже подощвенной поверхности стоп
- рак кожи губ
По результатам исследования ткани опухоли выделяют ороговевающую и неороговевающую формы плоскоклеточного рака кожи.
Для ороговевающей формы характерно более доброкачественное течение, медленный рост. Такие образования почти всегда имеют трудно отделяющиеся чешуйки на поверхности (признаки кератинизации), центральная язва также покрыта коркой. Опухоль красного, желтоватого или цвета обычной кожи; форма — многоугольная, овальная или круглая, чаще всего одиночная.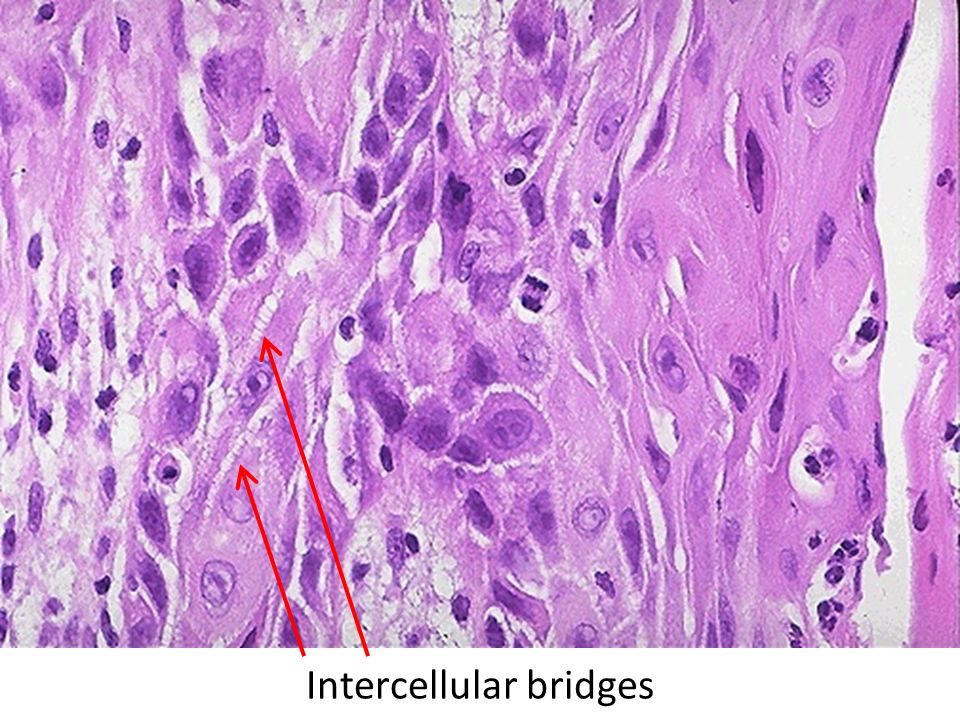
Неороговевающая форма — более злокачественное заболевание, быстро разрастающееся в окружающие ткани, признаки кератинизации отсутствуют. Опухоль — мясистая, мягкая, имеет вид узла или пятна, с покрытой коркой красно-бурой язвой, кровоточащая при контакте. Образование имеет неправильную форму, похожую на цветную капусту. Поражение лимфатических узлов начинается раньше и происходит чаще, чем при ороговевающей форме рака.
МЕТАСТАЗИРОВАНИЕ
Различные формы плоскоклеточного рака кожи метастазируют по-разному, например веррукозная форма метастазирует крайне редко, а неороговевающая — довольно рано поражает регионарные лимфатические узлы. При метастазировании отдаленные метастазы в легкие и кости встречаются в 15% случаев, а в 85% случаев в процесс вовлекаются лимфатические узлы.
Стадии плоскоклеточного рака устанавливают по международной классификации TNM, где Т – характеризует первичную опухоль, N-поражение регионарных лимфатических узлов, M – наличие отдаленных метастазов.
клиника, диагностика, методы лечения и профилактики
Плоскоклеточный рак кожи (ПКРК) (син.: спиноцеллюлярный рак, сквамозно-клеточная карцинома, плоскоклеточная эпителиома, эпидермоидный рак, спиналиома) — самая злокачественная эпителиальная опухоль кожи и слизистых оболочек с плоскоклеточной дифференцировкой, развивающаяся из кератиноцитов [1]. ПКРК входит в группу немеланомных злокачественных новообразований кожи (НМЗНК) и характеризуется агрессивным течением за счет большой вероятности метастазирования [1, 2]. ПКРК характеризуется деструктивным ростом с постепенным прогрессированием опухолевого процесса и инфильтрацией подлежащих тканей, метастазированием в регионарные и отдаленные лимфатические узлы (ЛУ) (в 85% случаев), также гематогенным распространением метастазов во внутренние органы (в 15%), такие как легкие и кости, что может привести к смерти больного [1, 3].
Во всем мире отмечается неуклонный рост числа впервые диагностированных случаев НМЗНК, в связи с чем в настоящее время рак кожи специалисты оценивают как «тихую эпидемию» [2, 4]. При анализе статистических данных по РФ за последние 7 лет отмечается тенденция к росту заболеваемости новообразованиями кожи [4]. Опухоли эпителиального происхождения занимают первое место в структуре заболеваемости всеми злокачественными новообразованиями кожи, на долю ПКРК приходится около 20% [4, 5]. Самая высокая заболеваемость в России наблюдается в Краснодарском и Ставропольском крае, в Астраханской и Ростовской областях, что отражает важную роль интенсивного воздействия ультрафиолетовых (УФ) лучей в этиологии заболевания [1, 3, 4]. Пациенты с диагнозом ПКРК находятся в группе повышенного риска развития рака внекожной локализации и другого НМЗНК [1, 5]. За последние десятилетия рост заболеваемости ПКРК сопровождался снижением уровня смертности на 20%, что связано с улучшением качества диагностики заболевания на ранних стадиях и активным лечением [5, 6]. Предполагают, что в результате истончения озонового слоя и соответственно возрастания интенсивности УФ-излучения, заболеваемость раком кожи будет увеличиваться до тех пор, пока поведенческие привычки человека не поменяются с целью уменьшения воздействия на него солнечного облучения [1, 7, 8].
При анализе статистических данных по РФ за последние 7 лет отмечается тенденция к росту заболеваемости новообразованиями кожи [4]. Опухоли эпителиального происхождения занимают первое место в структуре заболеваемости всеми злокачественными новообразованиями кожи, на долю ПКРК приходится около 20% [4, 5]. Самая высокая заболеваемость в России наблюдается в Краснодарском и Ставропольском крае, в Астраханской и Ростовской областях, что отражает важную роль интенсивного воздействия ультрафиолетовых (УФ) лучей в этиологии заболевания [1, 3, 4]. Пациенты с диагнозом ПКРК находятся в группе повышенного риска развития рака внекожной локализации и другого НМЗНК [1, 5]. За последние десятилетия рост заболеваемости ПКРК сопровождался снижением уровня смертности на 20%, что связано с улучшением качества диагностики заболевания на ранних стадиях и активным лечением [5, 6]. Предполагают, что в результате истончения озонового слоя и соответственно возрастания интенсивности УФ-излучения, заболеваемость раком кожи будет увеличиваться до тех пор, пока поведенческие привычки человека не поменяются с целью уменьшения воздействия на него солнечного облучения [1, 7, 8].
К факторам риска, способствующим развитию ПКРК, относят нижеследующие.
1. Избыточная инсоляция. Длительное и чрезмерное воздействие УФ-лучей (естественных или искусственных), предшествующее воздействие ионизирующего или теплового излучения, солнечные ожоги в анамнезе [1, 7, 8].
2. Возраст. Заболеваемость ПКРК увеличивается с возрастом. После 40 лет заболеваемость резко увеличивается [6, 7].
3. Пол. Заболеваемость у мужчин в 2 раза выше, чем у женщин, что, вероятно, связано с большей экспозицией УФ-лучей в течение жизни у мужчин [6, 7].
4. Индивидуальные факторы риска: I и II фототипы кожи, рак кожи в семейном анамнезе [1, 3, 7].
5. Мутация гена ТР53 — ген супрессора опухолевого роста. Ген ТР53 является ключевым механизмом защиты от рака кожи, реализующийся за счет уничтожения мутировавших предраковых клеток [1, 9].
6. Ген меланогенеза, кодирующий рецептор меланокортина 1-го типа (MC1R).
7. Генодерматозы: окулокутанный альбинизм, пигментная ксеродерма, порокератоз, эксцентрический гиперкератоз, дистрофическая форма буллезного эпидермолиза [1, 6].
8. Ассоциация с папилломавирусной инфекцией. Вирус папилломы человека (ВПЧ) типов 16, 18, 31, 33, 35 и 45 вызывает ПКРК вульвы, полового члена, заднепроходного отдела и ногтевых валиков [1, 6, 7].
9. Канцерогенные вещества: никотин, инсектициды, гербициды, каменноугольная смола, мышьяк, сажа, парафин, неочищенный керосин, креозот [6].
10. Иммуносупрессивные состояния: прием цитостатиков, иммуносупрессантов, состояние после трансплантации органов, хронический лимфолейкоз, лимфома, лейкемия, ВИЧ/СПИД [6, 7].
11. Физические факторы: длительные механические раздражения и повреждения кожи, местное применение лекарственных средств, содержащих ртуть, хлорметин, мышьяк [1, 7].
12. Предраковые заболевания кожи: актинический кератоз, болезнь Боуэна, эритроплазия Кейра, злокачественная лейкоплакия [1, 7, 10].
13. Сопутствующая патология: очагово-рубцовые атрофии, рубцы после ожогов, травм и лучевых повреждений, хронические язвы, дренирующие свищевые ходы, кератоакантома, туберкулезная волчанка, скрофулодерма, остроконечные кондиломы, крауроз, красная волчанка [1, 6, 10].
Клиническая картинаКлинически ПКРК, как правило, представляет собой единичный очаг, но может встречаться несколько очагов [10, 11]. Опухоль обычно локализуется на открытых участках кожи. В 70% случаев поражается лицо (нос, периорбитальные области, ушные раковины, височная область, лоб) [1, 6, 11]. Чаще всего наблюдается поражение кожи в переходных зонах между плоским эпителием и слизистой оболочкой (красная кайма губ, наружные половые органы, перианальная область) [10, 12]. Наиболее частой локализацией ПКРК на слизистой оболочке полости рта является небо и язык, обычно развивается на фоне эритроплакии, чаще протекает бессимптомно, постепенно превращаясь в твердый узел или перитонзилярный абсцесс [6, 11]. На нижней губе ПКРК развивается на фоне актинического хейлита или чешуйчатой лейкоплакии и в последующем медленно прогрессирует в опухолевый узел [6, 12]. На вульве ПКРК часто развивается на фоне склероатрофического лихена. ПКРК шейки матки ассоциирован с ВПЧ-инфекцией 16-го типа, а ПКРК полового члена часто развивается на фоне эритроплазии Кейра [6, 13].
Наиболее частой локализацией ПКРК на слизистой оболочке полости рта является небо и язык, обычно развивается на фоне эритроплакии, чаще протекает бессимптомно, постепенно превращаясь в твердый узел или перитонзилярный абсцесс [6, 11]. На нижней губе ПКРК развивается на фоне актинического хейлита или чешуйчатой лейкоплакии и в последующем медленно прогрессирует в опухолевый узел [6, 12]. На вульве ПКРК часто развивается на фоне склероатрофического лихена. ПКРК шейки матки ассоциирован с ВПЧ-инфекцией 16-го типа, а ПКРК полового члена часто развивается на фоне эритроплазии Кейра [6, 13].
На основании клинических признаков выделяют экзофитную и эндофитную формы роста опухоли [6, 12, 14].
1. Экзофитная (папиллярная) форма ростаПервичный узелок увеличивается в размере, возвышаясь над уровнем окружающей кожи, образуется большое количество роговых масс, очаг приобретает бугристый вид темно-красного или коричневого цвета с множеством расширенных мелких кровеносных сосудов и углублением в центре. Основание опухоли широкое и малоподвижное за счет прорастания в подлежащие ткани. Позднее происходит изъязвление опухоли с переходом в эндофитную форму роста [6, 10, 11].
Основание опухоли широкое и малоподвижное за счет прорастания в подлежащие ткани. Позднее происходит изъязвление опухоли с переходом в эндофитную форму роста [6, 10, 11].
Экзофитная форма ПКРК может приобретать вид желто- или красно-коричневого очага, с неровной поверхностью, покрытой коркой с гиперкератозом и бородавчатыми разрастаниями (так называемая веррукозная форма роста ПКРК, для которой характерен медленный рост, редкое метастазирование и тенденция к образованию на местах хронического раздражения кожи; может проявляться в виде «кожного рога») [6, 14, 15].
В зависимости от локализации выделяют четыре варианта веррукозной карциномы:
Тип I. Цветущий папилломатоз ротовой полости. Опухоль полости рта, преимущественно на слизистой щек, языка, десен и дна полости рта у пациентов, жующих табак.
Тип II. Аногенитальный тип. На мошонке, головке полового члена, в перианальной области, на наружных половых органах женщин.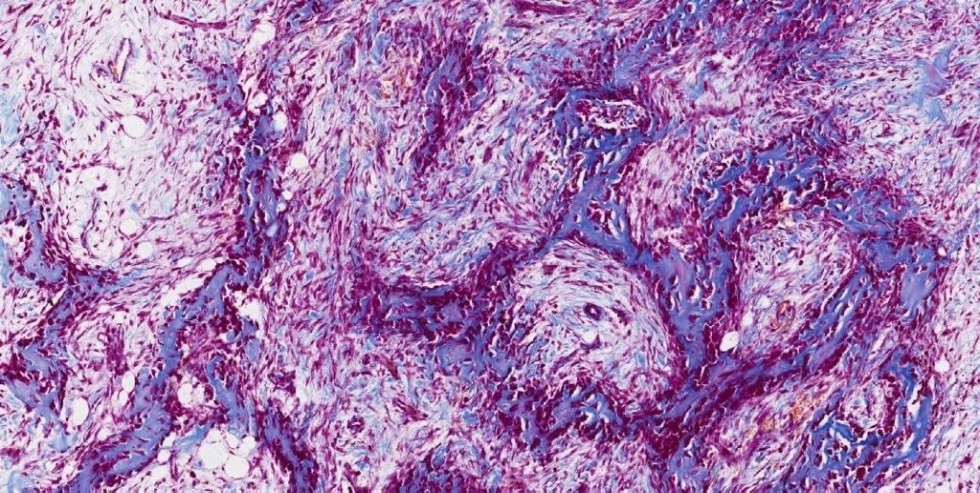
Тип III. Подошвенная карцинома. Опухоль на подошвах у пожилых мужчин.
Тип IV. Веррукозная карцинома на остальных участках кожного покрова (кожа волосистой части головы, туловища, конечностей) [6].
2. Эндофитная (язвенно-инфильтративная) форма роста
Первичным элементом является папула, которая впоследствии преобразуется в плотный узел, спаянный с подкожно-жировой клетчаткой. Через несколько месяцев узел изъязвляется с образованием язвы неправильной формы с шероховатым, плотным дном и белесоватой пленкой на поверхности, края язвы кратерообразно приподняты [6, 12, 13]. При прикосновении узел может кровоточить. Данная форма ПКРК быстро распространяется на подлежащие ткани, мышцы, сосуды, хрящи и кости, характеризуется частыми рецидивами и метастазами [1, 6, 15].
ГистопатологияГистологически различают две формы ПКРК.:max_bytes(150000):strip_icc()/cytoskeleton-5a04c193e258f800374f0df0.jpg)
1. Ороговевающая форма:
1.1. высокодифференцированная;
1.2. малодифференцированная.
2. Неороговевающая форма (недифференцированная).
При ороговевающей форме ПКРК отмечается доброкачественное течение, медленный рост, инвазия в глубь тканей постепенная. Кератинизация выражена хорошо, отмечаются так называемые роговые жемчужины — очаги гиперкератоза округлой формы с признаками незавершенной кератинизации в центре. Пальпаторно очаги плотной консистенции, обнаруживаются признаки ороговения. Визуально определяются папула, бляшка или узел, покрытые плотными роговыми чешуйками, в центре образования — эрозия или язва, покрытые коркой; края плотные, приподнятые, ороговевшие. При надавливании могут иногда выделяться роговые массы [1, 6, 15].
Неороговевающая форма характеризуется более злокачественным течением, быстрой инвазией в глубокие слои дермы, частым метастазированием. При данной форме ПКРК признаки кератинизации отсутствуют, атипизм клеток резко выражен, они имеют гиперхромные или распадающиеся ядра, наблюдается множество патологических митозов. Клинически данная форма представлена узлами или папулами с элементами вегетации, ороговение практически не наблюдается, в последующем происходит быстрое развитие эрозии или язвы с некротизированным дном и контактной кровоточивостью [6, 12, 15].
При данной форме ПКРК признаки кератинизации отсутствуют, атипизм клеток резко выражен, они имеют гиперхромные или распадающиеся ядра, наблюдается множество патологических митозов. Клинически данная форма представлена узлами или папулами с элементами вегетации, ороговение практически не наблюдается, в последующем происходит быстрое развитие эрозии или язвы с некротизированным дном и контактной кровоточивостью [6, 12, 15].
A. Broders (1932) предложил различать четыре степени злокачественности ПКРК в зависимости от соотношения в опухоли дифференцированных и недифференцированных клеток, а также от степени их атипии и глубины инвазии (табл. 1) [1, 6].
Таблица 1. Классификация ПКРК по Broders
В гистологической классификации опухолей кожи ВОЗ (1996) указаны следующие варианты ПКРК:
1) веретеноклеточный;
2) акантолитический;
3) веррукозный с формированием кожного рога;
4) лимфоэпителиальный.
Веретеноклеточный тип характеризуется выраженным инвазивным ростом, частым рецидивированием, метастазированием и неблагоприятным прогнозом. Гистологически обнаруживают структуры, состоящие из веретеноклеточных элементов, при этом четких признаков кератинизации нет. Может напоминать саркому и веретеноклеточную меланому, однако при электронной микроскопии эпителиальное происхождение доказано на основании обнаружения десмосом и тонофиламентов [6, 7].
Гистологически обнаруживают структуры, состоящие из веретеноклеточных элементов, при этом четких признаков кератинизации нет. Может напоминать саркому и веретеноклеточную меланому, однако при электронной микроскопии эпителиальное происхождение доказано на основании обнаружения десмосом и тонофиламентов [6, 7].
Акантолитический тип развивается на фоне актинического кератоза. Гистологически отмечают деструкцию опухолевых комплексов и тяжей, их превращение в тубулярные и псевдоальвеолярные структуры, выстланные одним или несколькими рядами атипичных клеток, при этом кератинизация отмечается не всегда. Иногда обнаруживают акантолитические или дискератотические клетки [1, 6, 10].
Веррукозный тип с образованием кожного рога характеризует выраженный гиперкератоз в поверхностных отделах опухоли с образованием рогового выроста [2, 6, 14].
Лимфоэпителиальный тип представлен тяжами и ячейками низкодифференцированных опухолевых клеток, расположенных в густом лимфоидном инфильтрате. В связи с отсутствием связи с эпидермисом и обнаружением внутрицитоплазматической слизи в опухолевых клетках предполагают, что данный гистологический вариант скорее является низкодифференцированной опухолью из придатков кожи, чем истинным ПКРК [6, 13].
В связи с отсутствием связи с эпидермисом и обнаружением внутрицитоплазматической слизи в опухолевых клетках предполагают, что данный гистологический вариант скорее является низкодифференцированной опухолью из придатков кожи, чем истинным ПКРК [6, 13].
В связи с наличием прямой зависимости эффективности лечения от стадии онкологического процесса существует три уровня диагностики ПКРК: ранняя, своевременная и поздняя [6, 16].
При ранней диагностике ПКРК выявляется на стадии in situ или в I клинической стадии, когда еще нет метастазирования. При выборе адекватной тактики лечения возможно полное выздоровление пациента. Своевременным считают диагноз ПКРК, поставленный на стадии Т1—Т2N0M0 [6]. Поздняя диагностика заключается в установлении диагноза на стадии Т3—Т4 и характеризуется неблагоприятным прогнозом из-за сложности или невозможности проведения радикального лечения, так как на этой стадии уже имеются регионарные или отдаленные метастазы [1, 6, 13].
«Золотым стандартом» верификации ПКРК является морфологическая диагностика. Так, особенно информативны иммунологические методы исследования. В связи с наружной локализацией опухоли и легкостью получения материала для исследования морфологическая верификация достигает 99% [13]. В гистологическом заключении должны быть указаны: гистологический тип опухоли, степень дифференцировки (по Broders), толщина опухоли, степень инвазии в дерму (по Кларку), отсутствие или наличие периневральной, околососудистой или перилимфатической инвазии [1, 13].
Диагностическими критериями ПКРК при дерматоскопии служат центральные кератиновые пробки, центральное древовидное ветвление сосудов, сосуды по типу шпилек для волос в периферическом венчике молочного цвета [15, 16].
Также для диагностики ПКРК можно использовать лазероиндуцированную флюоресцентную и спектральную диагностику с фотосенсибилизатором, ультразвуковое диагностическое сканирование, конфокальную лазерную сканирующую микроскопию [14].
При всех формах ПКРК, помимо тщательного сбора анамнеза и физикального осмотра всего кожного покрова и слизистой оболочки полости рта, необходимо также проводить оценку лимфатических узлов (ЛУ). При необходимости показано проведение диагностической тонкоигольной аспирации (ТИА) и дополнительных визуальных методов исследования (рентгенография, ангиография, компьютерная томография, ультразвуковая диагностика, эндоскопия) для обнаружения регионарных и отдаленных метастазов [1, 14].
Дифференциальная диагностикаДифференциальный диагноз при ПКРК проводят с актиническим кератозом, себорейным кератозом, базально-клеточным раком кожи, кератоакантомой, бородавчатой дискератомой, псевдокарциноматозной гиперплазией эпидермиса, амеланотической злокачественной меланомой [1, 6].
Методы леченияКак правило, план лечения больных ПКРК определяет консилиум врачей, состоящий из онколога, дерматолога, хирурга, радиолога и химиотерапевта. Многим пациентам может понадобиться дополнительная психологическая поддержка. Все специалисты, работающие с онкологическими больными, должны обладать специальными навыками общения [1, 6, 17].
Многим пациентам может понадобиться дополнительная психологическая поддержка. Все специалисты, работающие с онкологическими больными, должны обладать специальными навыками общения [1, 6, 17].
Выбор первичного метода лечения должен учитывать индивидуальные факторы риска и потребности пациента, обеспечивать полную, гистологически подтвержденную элиминацию опухолевых клеток и всех метастазов, сохранение функции пораженного органа и наиболее приемлемый косметический результат [1, 6, 10]. При выборе метода лечения необходимо учитывать факторы, связанные с самим опухолевым процессом: локализация и размер очага, клиническая форма, степень дифференцировки, наличие первичного очага или рецидива, ПКРК единичный или множественный, глубина инвазии, скорость роста, возможность определения границ очага [6, 17, 18].
Факторы риска рецидивирования и метастазирования1. Локализация. От расположения очага ПКРК зависит прогноз течения патологического процесса. Ниже перечислены анатомические зоны в порядке увеличения риска развития рецидивов и метастазирования.
От расположения очага ПКРК зависит прогноз течения патологического процесса. Ниже перечислены анатомические зоны в порядке увеличения риска развития рецидивов и метастазирования.
1.1. ПКРК на открытых участках кожного покрова, за исключением губ и ушных раковин.
1.2. ПКРК на губах.
1.3. ПКРК на ушных раковинах.
1.4. ПКРК на закрытых участках кожи (промежность, крестец, стопы).
1.5. ПКРК на месте радиационного или термического поражения, хронических язв, хронического воспаления или болезни Боуэна.
2. Размер. Опухоли диаметром более 2 см по сравнению с очагами диаметром до 2 см в 2 раза чаще приводят к рецидивированию (15,2 и 7,4% соответственно) и в 3 раза выше их способность к метастазированию (30,3 и 9,1% соответственно) [1, 10].
3. Толщина и уровень инвазии. Опухоли более 4 мм в толщину (за исключением поверхностного рогового слоя) или с инвазией в дерму по сравнению с опухолями тоньше 4 мм более подвержены рецидивированию и метастазированию (уровень метастазирования 45,7%). Опухоли менее 2 мм в толщину метастазируют реже [5, 6, 13].
Опухоли менее 2 мм в толщину метастазируют реже [5, 6, 13].
4. Этиология. Метастазирование ПКРК, возникшего на фоне актинического кератоза, происходит в 0,5% случаев, на фоне болезни Боуэна — в 2% случаев, на фоне позднего лучевого дерматита — около 20%, эритроплазии Кейра — 20%, на фоне рубцовых изменений — более 30% случаев [1, 6, 13].
5. Гистологическая дифференцировка и подтип. Низкодифференцированные опухоли имеют неблагоприятный прогноз (вероятность рецидивирования удваивается, а вероятность метастазирования возрастает в 3 раза), чем при высокодифференцированных опухолях. Акантолитический и веретенообразный подтипы имеют серьезный прогноз, в то время как веррукозный обладает более благоприятным течением. Очаги с вовлечением сосудов и периневральных структур часто рецидивируют и метастазируют [1, 6, 13].
6. Иммунный статус пациента. У пациентов с иммуносупрессивным состоянием прогноз менее благоприятный. Состояние иммунитета пациента влияет на степень инвазии и вероятность метастазирования [6, 12].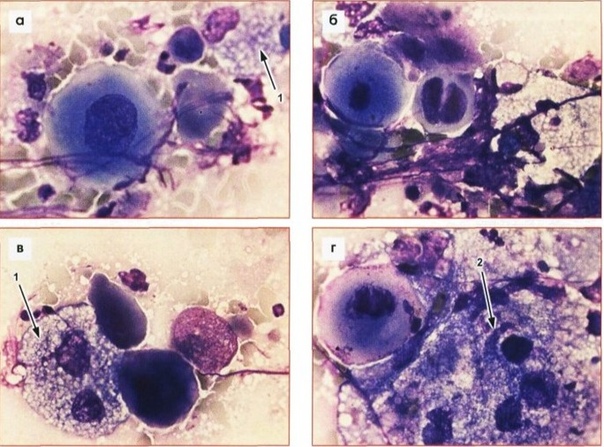
7. Проводимое ранее лечение и методы лечения.
Наименьшей вероятностью рецидивирования и метастазирования характеризуется операция по Мохсу [1, 6, 15]. Для определения наиболее эффективной тактики терапии для каждого отдельного пациента разработана концепция ПКРК «низкого риска» и «высокого риска» (табл. 2) [1, 6, 13].
Таблица 2. Плоскоклеточный рак кожи низкого и высокого риска
Существующие методы лечения ПКРК можно разделить на две большие группы: хирургические и нехирургические (табл. 3).
Таблица 3. Методы лечения плоскоклеточного рака кожи
1. Хирургическое лечение1.1. Хирургическая эксцизия
Хирургическая эксцизия ПКРК основана на иссечении опухоли в пределах здоровой кожи, с отступом 1,0—2,0 см от края периферической каймы эритемы вокруг очага с последующей пластикой или без нее [17]. При стадии T1N0M0 рецидивирование, как правило, не наблюдается, при T2—T3N0M0 может достигать 13,8%. Показатели 5-летней выживаемости значительно варьируют в зависимости от стадии: при T1N0M0 — 86,1%, T2N0M0 — 81,9%, при Т3N0M0 — 48,1%, при Т4N0M0 — 23,1% [18].
При стадии T1N0M0 рецидивирование, как правило, не наблюдается, при T2—T3N0M0 может достигать 13,8%. Показатели 5-летней выживаемости значительно варьируют в зависимости от стадии: при T1N0M0 — 86,1%, T2N0M0 — 81,9%, при Т3N0M0 — 48,1%, при Т4N0M0 — 23,1% [18].
Показания к хирургической эксцизии
1. ПКРК низкого риска.
2. Рецидивный ПКРК.
Противопоказания к хирургической эксцизии
1. ПКРК высокого риска.
2. Метастатический ПКРК.
3. Множественный ПКРК.
4. Высокий оперативный риск (преклонный возраст пациента, непереносимость обезболивающих средств, прием антикоагулянтов).
5. Невозможность полной резекции очага из-за его локализации (область вокруг глаз, нос, ушная раковина).
Недостатки метода: необходимость выполнения сложных реконструктивных операций в послеоперационном периоде, которые не всегда приводят к удовлетворительным эстетическим и функциональным результатам [17, 18].
1.2. Операция по Мохсу (Mohs)
Хирургическая операция по Мохсу (Mohs) является эффективным методом лечения ПКРК [19]. При операции по Мохсу проводится послойное удаление ПКРК, параллельно проводится гистологическое исследование криостатных срезов каждого удаленного слоя, благодаря чему удаление опухолевых клеток производится полностью при максимальном сохранении окружающей здоровой ткани. Показатель эффективности достигает 97,9% [19, 20].
Показания к операции по Мохсу:
1. ПКРК высокого риска.
2. ПКРК низкого риска.
3. Рецидивирующий ПКРК.
4. Метастатический ПКРК.
5. Множественный ПКРК.
6. Важная в косметическом отношении локализация очагов.
Противопоказание к операции по Мохсу — высокий риск оперативного вмешательства.
Недостатки метода: применение метода требует больших затрат времени и средств, также необходим специально обученный медицинский персонал для проведения операции и последующего морфологического исследования.
1.3. Электрокоагуляция и кюретаж
При проведении электрокоагуляции и кюретажа обязателен захват 5—6 мм прилегающей к очагу зоны здоровой кожи. Преимуществами метода являются простота и быстрота выполнения процедуры, однако впоследствии наблюдается высокая степень рецидивирования [17].
Показания к электрокоагуляции / кюретажу:
1. ПКРК низкого риска.
Противопоказания к электрокоагуляции/кюретажу:
1. ПКРК высокого риска.
2. Важная в косметическом отношении локализация очагов.
3. Рецидивирующий ПКРК.
4. Метастатический ПКРК.
5. Множественный ПКРК.
6. Очаги ПКРК на участках кожи, покрытых волосами (риск неадекватного удаления опухоли, распространяющейся на фолликулярные структуры).
7. Пациенты с кардиостимулятором.
Недостатки метода: невозможность получить адекватный материал для гистологического контроля краев удаленной опухоли, в связи с чем требуется тщательное наблюдение за больными. Также метод не обеспечивает достаточный косметический результат (высокий риск повреждения нервов, сосудов и связок, формирования гипертрофических рубцов, зон гипопигментации) [1, 18].
Также метод не обеспечивает достаточный косметический результат (высокий риск повреждения нервов, сосудов и связок, формирования гипертрофических рубцов, зон гипопигментации) [1, 18].
Криодеструкция проводится в несколько циклов, время экспозиции определяется анатомической локализацией и клинической формой очага. Криодеструкцию проводят с захватом 2,0—2,5 см визуально здоровой кожи вокруг опухоли. К преимуществам метода относятся возможность проведения процедуры в амбулаторных условиях и незначительная болезненность.
Показания к криодеструкции:
1. ПКРК низкого риска.
Противопоказания к криодеструкции:
1. ПКРК высокого риска.
2. Рецидивирующий ПКРК.
3. Метастатический ПКРК.
4. Множественный ПКРК.
5. Важная в косметическом отношении локализация очагов.
6. Криоглобулинемия.
Криоглобулинемия.
7. Криофибриногенемия.
8. Холодовая агглютинация.
9. Феномен Рейно.
10. Аутоиммунные заболевания.
Недостатки метода: гистологический контроль за краями удаленной опухоли невозможен. Период заживления составляет 2—4 нед с последующим формированием атрофического гипопигментированного рубца. Возможно неконтролируемое промораживание с последующей деструкцией подлежащих тканей, развитием нейропатии, аллопеции [1, 7, 21].
3. ЛазеротерапияМеханизм лазеротерапии заключается в появлении локального коагуляционного некроза тканей с четкими границами. Используются неодимовый или СО2-лазер. Метод обеспечивает хороший косметический результат. По последним данным известно, что при использовании лазеров в инфракрасной полосе излучения достигается выраженный противоопухолевый эффект за счет гипертермии и генерации токсичного синглетного кислорода в толще подлежащих тканей [1, 20].
Показания к лазеротерапии.
1. ПКРК низкого риска.
2. Пациенты, получающие терапию антикоагулянтами.
3. Пациенты, страдающие заболеваниями с повышенной кровоточивостью.
Противопоказания к лазеротерапии:
1. ПКРК высокого риска.
2. Рецидивирующий ПКРК.
3. Метастатический ПКРК.
4. Множественный ПКРК.
5. Важная в косметическом отношении локализация очагов.
6. Склонность к образованию келоидных рубцов.
Недостатки метода: невозможность получить адекватный материал для гистологического контроля краев удаленной опухоли, в связи с чем требуется тщательное наблюдение за больными.
4. Лучевая терапияПКРК относится к категории опухолей с относительно высокой чувствительностью к лучевому лечению, которое широко применяется как в режиме монотерапии, так и в комбинации с другими методами лечения. При небольших очагах ПКРК целесообразно использование близкофокусного рентгеновского излучения, при больших очагах и отсутствии регионарных метастазов — дистанционной гамма-терапии. В случае определения регионарных метастазов проводят комбинированное лечение, включающее предоперационную лучевую терапию и хирургическое удаление опухоли одновременно с радикальной лимфаденэктомией.
При небольших очагах ПКРК целесообразно использование близкофокусного рентгеновского излучения, при больших очагах и отсутствии регионарных метастазов — дистанционной гамма-терапии. В случае определения регионарных метастазов проводят комбинированное лечение, включающее предоперационную лучевую терапию и хирургическое удаление опухоли одновременно с радикальной лимфаденэктомией.
При проведении лучевой терапии необходимо сохранение жизнеспособности здоровых тканей, находящихся в зоне воздействия, в связи с чем доза облучения должна быть толерантной. Режим облучения зависит от локализации очага, его размера, от степени клеточной дифференцировки: высокодифференцированный ПКРК требует больших доз облучения, чем низкодифференцированный. Доза облучения варьирует от 3 до 5 Гр/сут (суммарно на курс 50—80 Гр).
При стадии Т1—Т2 показатели 5-летней выживаемости после радикальной лучевой терапии могут достигать 96%. При стадиях Т3 и Т4 лучевую терапию используют в качестве пред- и послеоперационного лечения, однако у ¼ больных в последующем развивается рецидив ПКРК, который уже будет резистентный к повторным курсам лучевой терапии [22].
Показания к лучевой терапии:
1. Т1—Т2 стадии — самостоятельный метод.
2. Т3—Т4 стадии — пред- и послеоперационное лечение.
3. Неоперабельный ПКРК — паллиативный метод.
4. Периневральное вовлечение — адъювантная лучевая терапия.
5. ПКРК высокого риска (до 15 мм в диаметре).
6. Глубокоинвазивный ПКРК.
7. Метастатический ПКРК.
Противопоказания к лучевой терапии:
1. Рецидивный ПКРК.
2. Веррукозная карцинома.
3. Генетические состояния, предрасполагающие к развитию рака кожи (синдром базально-клеточного невуса, пигментная ксеродерма).
4. Заболевания соединительной ткани (красная волчанка, склеродермия).
Недостатки метода: возможно развитие лучевых периоститов, перихондритов костей черепа, носа, хрящей ушной раковины, а также конъюнктивита, катаракты, неудовлетворительных в косметическом отношении рубцовых деформаций [22—24].
5. Химиотерапия
ХимиотерапияЕдиного взгляда на проблему химиотерапии рака кожи пока нет. При местной химиотерапии ПКРК используются 5% фторурациловая, 5—10% фторафуровая, 30—50% проспидиновая мази, 30% глицифоновая или 0,5—10% омаиновая (колхаминовая) мазь. Эффективность метода довольно низкая, а степень рецидива высокая. Также возможно применение системных цитостатических препаратов (5-фторурацил) для внутрикожных или подкожных инъекций в очаг и окружающую зону здоровой кожи. Системная химиотерапия (цисплатин, карбоплатин, 5-фторурацил, блеомицин, цетуксимаб) может применяться при невозможности проведения радикального удаления очага или в качестве предоперационной процедуры для уменьшения размера опухолевого очага, а также при метастазирующем ПКРК. В отдельных случаях используют полихимиотерапию [25, 26].
Показания к химиотерапии:
1. Рецидивирующий ПКРК.
2. Множественный ПКРК.
3. Неоперабельный ПКРК.
4. Метастазирующий ПКРК.
5. Больные пожилого возраста, имеющие противопоказания к другим методам лечения.
Противопоказания к химиотерапии:
1. Тяжелая сопутствующая патология.
2. Иммунодефицитное состояние.
Недостатки метода: применение цитостатических мазей может вызывать интоксикацию и препятствовать заживлению образовавшихся язв.
6. ИнтерферонотерапияДля лечения плоскоклеточного рака кожи используют местные или системные иммуномодулирующие препараты: рекомбинантные интерфероны — альфа-2b-реаферон, виферон (Россия), интрон, А (США), местный иммунотропный препарат крем имиквимод [26—28].
Показания к интерферонотерапии:
1. Отказ пациента от хирургического лечения.
2. Крупные неоперабельные ПКРК.
Противопоказания к интерферонотерапии:
1. Тяжелая сопутствующая патология в стадии декомпенсации.
Тяжелая сопутствующая патология в стадии декомпенсации.
2. Аутоиммунные заболевания.
3. Тромбоцитопения, лейкопения.
4. Депрессия.
5. Эпилепсия.
Недостатки метода: частое развитие побочных эффектов после системной интерферонотерапии (слабость, энцефалопатия, анорексия, лейкопения, тромбоцитопения, тошнота, диарея). После местного применения крема имиквимод часто наблюдается выраженная воспалительная реакция в месте его применения. Также к недостаткам интерферонотерапии можно отнести довольно высокую стоимость процедуры при относительно низкой степени излеченности.
7. Лазероиндуцированная свето-кислородная терапия (ЛИСКТ)Метод находится в стадии разработки, заключается в прямой фотогенерации цитотоксичного синглетного кислорода из имеющегося в организме пациента кислорода. Светокислородная деструкция клеток возможна при уровне световой интенсивности, применяемой при фотодинамической терапии [29].
Метод фотодинамической терапии (ФДТ) относится к современным физическим методам лечения в онкологии. ФДТ является малоинвазивным и эффективным методом лечения ПКРК, основанным на использовании фотодинамического повреждения опухолевых клеток в ходе фотохимических реакций [30, 31]. После введения в организм специального вещества — фотосенсибилизатора (ФС) — проводится облучение фотосенсибилизированной ткани лазером с определенной длиной волны, в результате чего происходит переход нетоксичного триплетного кислорода в цитотоксичный синглетный кислород, что приводит к селективному разрушению клеточных мембран опухолевых клеток, без повреждения окружающих здоровых клеток [30, 32, 33]. Эффективность ФДТ при ПКРК обеспечивается за счет 3 механизмов: цитотоксичности фотохимической реакции, повреждения сосудов опухоли, формирования иммунного ответа вокруг опухолевого очага. Цитотоксический эффект ФДТ напрямую зависит от концентрации ФС в опухолевой ткани и глубины проникновения света. Терапевтическая эффективность ФДТ в свою очередь зависит от стадии опухолевого процесса, его клинико-морфологических особенностей и эффективности ранее проводимых методов лечения. При локализации очага ПКРК в труднодоступных анатомических зонах применение ФДТ позволяет провести эффективное лечение с сохранением целостности органа. Процедуру ФДТ можно проводить многократно без риска развития местных или системных осложнений, в связи с чем в отдельных клинических ситуациях, в частности, когда возможности хирургического и лучевого лечения ограничены или исчерпаны, именно ФДТ является альтернативным, а иногда и единственным методом лечения, например при часто рецидивирующем течении процесса [30, 34, 35].
Цитотоксический эффект ФДТ напрямую зависит от концентрации ФС в опухолевой ткани и глубины проникновения света. Терапевтическая эффективность ФДТ в свою очередь зависит от стадии опухолевого процесса, его клинико-морфологических особенностей и эффективности ранее проводимых методов лечения. При локализации очага ПКРК в труднодоступных анатомических зонах применение ФДТ позволяет провести эффективное лечение с сохранением целостности органа. Процедуру ФДТ можно проводить многократно без риска развития местных или системных осложнений, в связи с чем в отдельных клинических ситуациях, в частности, когда возможности хирургического и лучевого лечения ограничены или исчерпаны, именно ФДТ является альтернативным, а иногда и единственным методом лечения, например при часто рецидивирующем течении процесса [30, 34, 35].
ФС вводятся в организм системно (перорально или внутривенно) или локально (аппликационно или интерстициально) [30, 36].
К системным ФС I поколения относят производные гематопорфирина: фотофрин (США), фотогем (Россия), фотосан (Германия). Для этой группы ФС характерна высокая фототоксичность при низком коэффициенте накопления в опухолевых клетках. Более перспективными являются ФС II поколения: фотодитазин (Россия), фотолон (Белоруссия), радахлорин (Россия), фоскан (Германия), аминолевулиновая кислота (АЛК) (Норвегия) [30, 31, 37].
Для этой группы ФС характерна высокая фототоксичность при низком коэффициенте накопления в опухолевых клетках. Более перспективными являются ФС II поколения: фотодитазин (Россия), фотолон (Белоруссия), радахлорин (Россия), фоскан (Германия), аминолевулиновая кислота (АЛК) (Норвегия) [30, 31, 37].
Наиболее распространенный метод системного введения ФС — внутривенный, который характеризуется накоплением препарата в опухолевой ткани, коже, слизистых оболочках, а также в органах с высокой метаболической активностью. Для системного применения ФС характерен длительный период кожной фототоксичности, в связи с чем пациентам после процедуры ФДТ необходимо строго соблюдать световой режим, длительность которого зависит от вида Ф.С. При использовании системных ФС I поколения — до 1 мес, II поколения фталоцианинов — до 6 мес, хлоринов — до нескольких дней [30, 32, 34]. При несоблюдении светового режима возможны такие осложнения, как ожоги кожи лица и других открытых участков кожи, отек, пигментация, а также конъюнктивиты и дерматиты. Перед системным введением ФС обязательно проводить оценку состояния внутренних органов с большой метаболической активностью, в частности, почек и печени и особенно у пожилых пациентов, так как накопление в них ФС может привести к нарушению их деятельности [31, 34, 38].
Перед системным введением ФС обязательно проводить оценку состояния внутренних органов с большой метаболической активностью, в частности, почек и печени и особенно у пожилых пациентов, так как накопление в них ФС может привести к нарушению их деятельности [31, 34, 38].
Локальный (аппликационный или интерстициальный) способ введения ФС в очаг не сопровождается вышеперечисленными осложнениями, при этом обладает достаточной эффективностью при лечении начальных стадий ПКРК низкого риска, при болезни Боуэна. Соблюдение светового режима не требуется, а также возможно лечение пожилых пациентов с тяжелыми сопутствующими соматическими заболеваниями [30, 34].
Одним из наиболее эффективных и современных местных фотосенсибилизаторов является метиламинолевулиновая кислота (МАЛК) — липофильный эфир АЛК, который выпускается в виде крема метвикс («Galderma», Швейцария). Для фотодинамической терапии с метиламинолевулиновой кислотой (МАЛК-ФДТ) характерен более приемлемый косметический результат по сравнению с традиционными методами лечения ПКРК, такими как хирургическое иссечение и криодеструкция, особенно при локализации очага в анатомических зонах, важных с эстетической точки зрения. В качестве источника света используется лампа, излучающая холодный видимый свет в красном спектре. Доза световой энергии зависит от размера и локализации очага [30, 38]. Метод МАЛК-ФДТ обладает рядом преимуществ: малоинвазивность, отсутствие токсического и иммунодепрессивного эффекта, селективность, органосохраняющий эффект, косметически приемлемый эффект, возможность многократного проведения процедуры, возможность работы с множественными очагами ПКРК, в том числе в труднодоступных анатомических зонах, возможность проведения процедуры пожилым пациентам, в том числе с тяжелой сопутствующей патологией [32, 33, 37].
В качестве источника света используется лампа, излучающая холодный видимый свет в красном спектре. Доза световой энергии зависит от размера и локализации очага [30, 38]. Метод МАЛК-ФДТ обладает рядом преимуществ: малоинвазивность, отсутствие токсического и иммунодепрессивного эффекта, селективность, органосохраняющий эффект, косметически приемлемый эффект, возможность многократного проведения процедуры, возможность работы с множественными очагами ПКРК, в том числе в труднодоступных анатомических зонах, возможность проведения процедуры пожилым пациентам, в том числе с тяжелой сопутствующей патологией [32, 33, 37].
Показания к системной ФДТ:
1. ПКРК in situ.
2. Резистентность опухоли к ранее проводимым стандартным методам лечения.
3. Невозможность выполнения хирургической операции из-за сопутствующей патологии.
4. Локализация в труднодоступных для иссечения местах (угол глаза, нос, ушная раковина).
5. Множественный ПКРК.
6. Рецидивный ПКРК.
7. Опухоли при высоком рис
Мелкоклеточный рак легкого
ГУ РОНЦ им. Н.Н.Блохина РАМН, Москва
М.Б. Бычков, Э.Н. Дгебуадзе, С.А. Большакова
В настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия.
Рак легкого является одним из наиболее распространенных онкологических заболеваний в мире. Немелкоклеточная (НМРЛ) и мелкоклеточная (МРЛ) формы рака легкого встречаются в 80-85% и 10-15% случаев, соответственно [41]. Как правило, мелкоклеточная его форма чаще всего встречается у курящих и очень редко у некурящих больных.
Как правило, мелкоклеточная его форма чаще всего встречается у курящих и очень редко у некурящих больных.
МРЛ относится к наиболее злокачественно текущим опухолям и характеризуется коротким анамнезом, быстрым течением, имеет тенденцию к раннему метастазированию. Мелкоклеточный рак легкого является опухолью, высокочувствительной к химиотерапии, при этом у большинства пациентов можно получить объективный эффект. При достижении полной регрессии опухоли проводится профилактическое облучение головного мозга, что позволяет уменьшить риск отдаленного метастазирования и увеличить уровень общей выживаемости [4].
При диагностике МРЛ особое значение имеет оценка распространенности процесса, определяющая выбор терапевтической тактики. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей.
В последнее время появились сообщения о том, что позитронно-эмиссионная томография позволяет дополнительно уточнить стадию процесса.
При МРЛ, как и при других формах рака легкого, используется стадирование по международной системе TNM, однако большинство больных МРЛ уже имеют на момент установления диагноза III-IV стадию заболевания, в связи с этим до настоящего времени не потеряла свое значение классификация, согласно которой различают локализованную и распространенную формы заболевания.
При локализованной стадии МРЛ опухолевое поражение ограничено одним гемитораксом с вовлечением в процесс регионарных ипсилатеральных лимфатических узлов корня и средостения, а также и ипсилатеральных надключичных лимфатических узлов, когда технически можно выполнить облучение с использованием одного поля.
Распространенной стадией заболевания считается процесс, когда опухолевое поражение не ограничено одним гемитораксом, с наличием контралатеральных лимфогенных метастазов или опухолевого плеврита.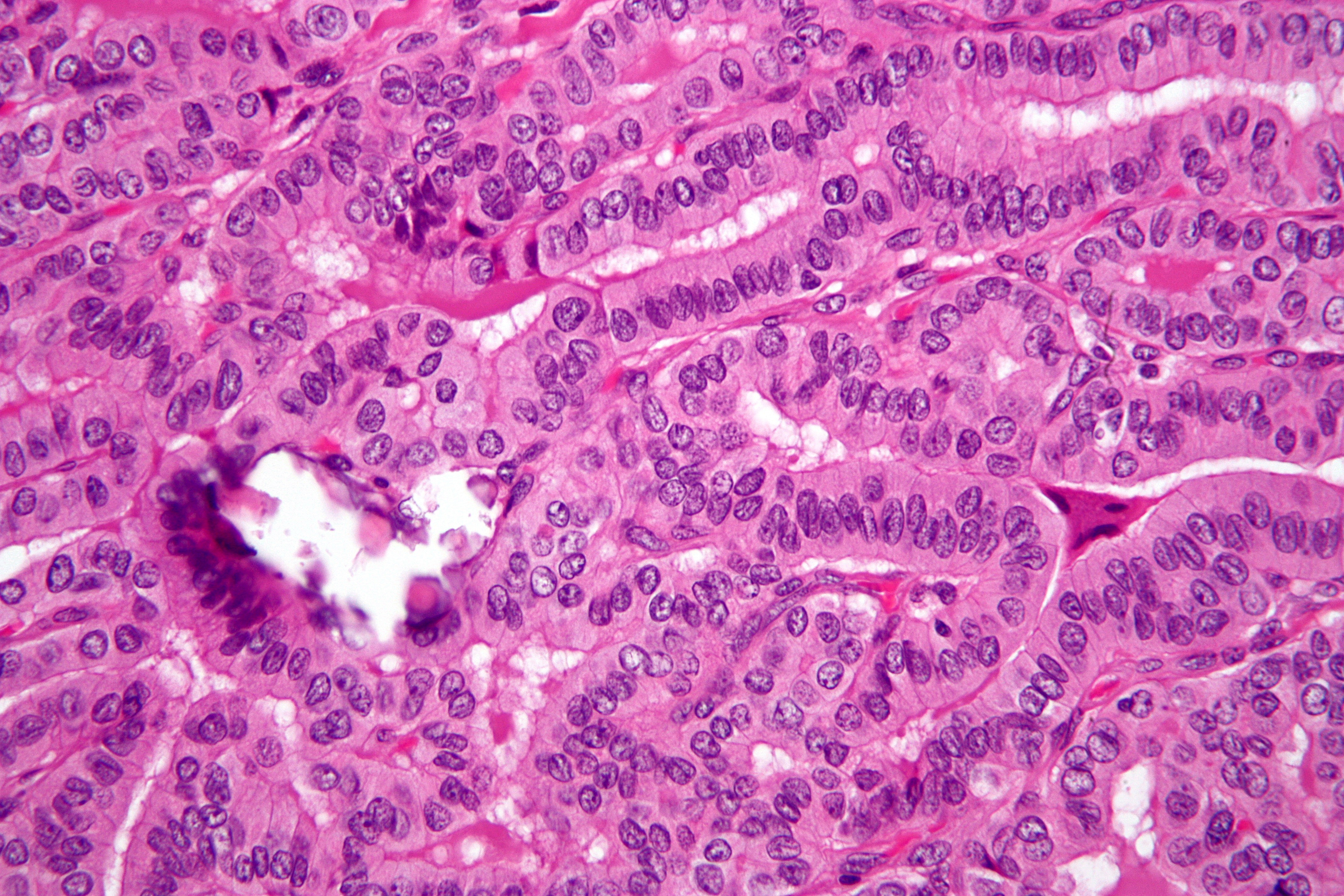
Стадия процесса, определяющая терапевтические возможности, является основным прогностическим фактором при МРЛ [1].
Прогностические факторы:
1. Степень распространенности процесса: у больных с локализованным процессом (не выходящим за пределы грудной клетки) достигаются лучшие результаты при химиолучевой терапии.
2. Достижение полной регрессии первичной опухоли и метастазов: отмечается существенное увеличение длительности жизни и имеется возможность полного выздоровления.
3. Общее состояние больного: пациенты, начинающие лечение в хорошем состоянии, имеют более высокую эффективность лечения, большую выживаемость, чем пациенты в тяжелом состоянии, истощенные, с выраженными симптомами болезни, гематологическими и биохимическими изменениями.
Принципы терапии мелкоклеточного рака легкого
Оперативное лечение показано только при ранних стадиях МРЛ (T1-2N0—1). Оно должно дополняться послеоперационной полихимиотерапией (4 курса). У данной группы больных 5-летняя выживаемость составляет 39% [33].
Оно должно дополняться послеоперационной полихимиотерапией (4 курса). У данной группы больных 5-летняя выживаемость составляет 39% [33].
Лучевая терапия приводит к регрессии опухоли у 6080% пациентов, однако в самостоятельном виде она не увеличивает продолжительность жизни из-за появления отдаленных метастазов [9].
Химиотерапия является краеугольным камнем лечения МРЛ. Среди активных препаратов следует отметить: цик- лофосфан, доксорубицин, винкристин, этопозид, топотекан, иринотекан, паклитаксел, доцетаксел, гемцитабин, винорельбин. Их эффективность в монотерапии колеблется от 25 до 50% [23, 35]. В табл. 1 представлены схемы современной комбинированной химиотерапии МРЛ.
Лечение больных с локализованной формой МРЛ
Эффективность современной терапии данной формы МРЛ колеблется от 65% до 90%, с полной регрессией опухоли у 45-75% больных и медианой выживаемости 1824 мес [15, 38]. Больные, начавшие лечение в хорошем общем состоянии (PS 0-1) и ответившие на индукционную терапию, имеют шансы на 5-летнюю безрецидивную выживаемость.
При локализованной форме МРЛ проводится химиотерапия (ХТ) по одной из вышеуказанных схем (2-4 курса) в сочетании с лучевой терапией (ЛТ) на область первичного очага, корня легкого и средостения с подведением суммарной очаговой дозы 30-45 Гр (50-60 Гр по изоэффекту) [6, 7, 37]. Начало лучевой терапии должно быть максимально приближено к началу химиотерапии, т.е. лучше всего ЛТ начинать либо на фоне проведения 1-2 курсов химиотерапии, либо после проведения оценки эффективности лечения двух курсов ХТ.
Больным, у которых достигнута полная ремиссия, рекомендуется проведение профилактического облучения головного мозга в суммарной дозе 30 Гр в связи с высоким риском (до 70%) метастазирования в головной мозг [4].
Медиана выживаемости больных с локализованной формой МРЛ при использовании комбинированного лечения составляет 16-24 мес, при этом 2-летняя выживаемость равна 40-50%, 5-летняя — 10%. У группы больных, начавших лечение в хорошем общем состоянии, возможности достижения 5-летней выживаемости составляют 25% [15, 38].
Лечение больных с распространенной формой МРЛ
У таких больных основным методом лечения является комбинированная химиотерапия в тех же режимах, а облучение проводится только по специальным показаниям. Общая эффективность химиотерапии составляет 70%, но полная регрессия достигается только у 20% больных [15]. В то же время, выживаемость пациентов при достижении полной регрессии опухоли достоверно выше, чем при получении частичной регрессии, и приближается к выживаемости больных с локализованной формой МРЛ.
Таблица №1.
Схемы современной комбинированной химиотерапии МРЛ
| Препараты | Схема химиотерапии | Интервал между курсами |
| ЕР
Цисплатин Этопозид | 80 мг/м2 внутривенно в 1-й день 120 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 3 нед |
| CDE
Циклофосфамид Доксорубицин Этопозид | 1000 мг/м2 внутривенно в 1-й день 45 мг/м2 внутривенно в 1-й день 100 мг/м2 внутривенно в 1,2,3-й дни или 1,3,5-й дни | 1 раз в 3 нед |
| CAV
Циклофосфамид Доксорубицин Винкристин | 1000 мг/м2 внутривенно в 1-й день 50 мг/м2 внутривенно в 1-й день 1,4 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| AVP
Нимустин (CCNU) Этопозид Цисплатин | 2-3 мг/кг внутривенно в 1-й день 100 мг/м2 внутривенно в 4,5,6-й дни 40 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 4-6 нед |
| CODE
Цисплатин Винкристин Доксорубицин Этопозид | 25 мг/м2 внутривенно в 1-й день 1 мг/м2 внутривенно в 1-й день 40 мг/м2 внутривенно в 1-й день 80 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в неделю в течение 8 нед |
| TC
Паклитаксел Карбоплатин | 135 мг/м2 внутривенно в 1-й день AUC 5 мг/м2 внутривенно в 1-й день | 1 раз в 3-4 нед |
| TP
Доцетаксел Цисплатин | 75 мг/м2 внутривенно в 1-й день 75 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| IP
Иринотекан Цисплатин | 60 мг/м2 внутривенно в 1,8,15-й дни 60 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| GP
Гемцитабин Цисплатин | 1000 мг/м2 внутривенно в 1,8-й дни 70 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
При метастатическом поражении костного мозга, отдаленных лимфатических узлов, при метастатическом плеврите основным методом лечения является химиотерапия. При метастатическом поражении лимфатических узлов средостения с синдромом сдавления верхней полой вены целесообразно применять комбинированное лечение (химиотерапию в сочетании с лучевой). При метастатическом поражении костей, головного мозга, надпочечников методом выбора является лучевая терапия. При метастазах в головной мозг лучевая терапия в суммарной очаговой дозе (СОД) 30 Гр позволяет получить клинический эффект у 70% больных, причем, у половины из них регистрируется полная регрессия опухоли по данным КТ [4]. В последнее время появились сообщения о возможности использования системной химиотерапии при метастазах в головной мозг. В табл. 2 представлена современная тактика лечения различных форм МРЛ.
При метастатическом поражении лимфатических узлов средостения с синдромом сдавления верхней полой вены целесообразно применять комбинированное лечение (химиотерапию в сочетании с лучевой). При метастатическом поражении костей, головного мозга, надпочечников методом выбора является лучевая терапия. При метастазах в головной мозг лучевая терапия в суммарной очаговой дозе (СОД) 30 Гр позволяет получить клинический эффект у 70% больных, причем, у половины из них регистрируется полная регрессия опухоли по данным КТ [4]. В последнее время появились сообщения о возможности использования системной химиотерапии при метастазах в головной мозг. В табл. 2 представлена современная тактика лечения различных форм МРЛ.
Терапевтическая тактика при рецидиве МРЛ
Несмотря на высокую чувствительность к химиотерапии и лучевой терапии МРЛ, это заболевание имеет высокий уровень рецидивов, в таком случае выбор препаратов для химиотерапии второй линии зависит от уровня ответа на первую линию лечения, длительности безрецидивного промежутка и от локализации метастатических очагов.
Принято различать больных с чувствительным рецидивом МРЛ, т.е. имевших в анамнезе полный или частичный эффект от первой линии химиотерапии и наличием прогрессирования не менее чем через 3 мес после окончания индукционной химиотерапии. В этом случае, возможно, повторно использовать схему лечения, на фоне которой выявлен эффект. Существуют пациенты с рефрактерным рецидивом, т.е. когда отмечается прогрессирование заболевания в процессе первой линии химиотерапии или менее чем через 3 мес после ее окончания. Прогноз заболевания у больных МРЛ особенно неблагоприятен для пациентов с рефрактерным рецидивом — в этом случае медиана выживаемости после диагностики рецидива не превышает 3-4 мес. При наличии рефрактерного рецидива целесообразно применение ранее не использовавшихся цитостатиков и/или их комбинаций.
В последнее время изучаются и уже используются новые препараты в терапии МРЛ, к ним относятся гемцитабин, топотекан, винорельбин, иринотекан, таксаны, а также таргетные препараты.
Гемцитабин. Гемцитабин является аналогом деокситидина и относится к пиримидиновым антиметаболитам. По данным исследования Y. Cornier и соавт., его эффективность в монотерапии составила 27%, по результатам датского исследования уровень общей эффективности составляет 13% [8]. Поэтому стали изучать комбинированные режимы химиотерапии с включением гемцитабина. В итальянском исследовании проводилось лечение по схеме PEG (гемцитабин, цисплатин, этопо- зид), при этом уровень объективной эффективности составил 72%, однако отмечена высокая токсичность [10]. London Lung Group опубликовали данные рандомизированного исследования III фазы по прямому сравнению двух схем лечения GC (гемцитабин + цисплатин) и РЕ. Различий в медианах выживаемости не было получено, здесь также отмечен высокий уровень токсичности схемы GC [20].
Топотекан. Топотекан — это водорастворимый препарат, являющийся полусинтетическим аналогом камптотецина, он не обладает перекрестной токсичностью с другими цитостатиками, использующимися при лечении МРЛ. Результаты некоторых исследований отмечают его эффективность и при наличии резистентных форм заболевания [3, 11, 13, 39, 40]. Также в этих работах выявлена хорошая переносимость топотекана, характеризующаяся управляемой некумулятивной миелосупрессией, низким уровнем негематологической токсичности и значительным уменьшением клинических проявлений заболевания [2, 12, 29, 30]. Использование топотекана во второй линии терапии МРЛ одобрено приблизительно в 40 странах мира, включая США и Швейцарию.
Результаты некоторых исследований отмечают его эффективность и при наличии резистентных форм заболевания [3, 11, 13, 39, 40]. Также в этих работах выявлена хорошая переносимость топотекана, характеризующаяся управляемой некумулятивной миелосупрессией, низким уровнем негематологической токсичности и значительным уменьшением клинических проявлений заболевания [2, 12, 29, 30]. Использование топотекана во второй линии терапии МРЛ одобрено приблизительно в 40 странах мира, включая США и Швейцарию.
Винорельбин. Винорельбин является полусинтетическим винкаалкалоидом, который участвует в предотвращении процессов деполимеризации тубулина. По данным некоторых исследований, уровень ответа при монотерапии винорельбином составляет 17% [16, 21]. Было также выявлено, что комбинация винорельбина и гемцитабина является достаточно эффективной и обладает невысоким уровнем токсичности. В работе J.D. Hainsworth и соавт. уровень частичной регрессии составил 28% [19]. Несколько исследовательских групп оценивали эффективность и токсический профиль комбинации карбоплатина и винорельбина [18, 24]. Полученные данные указывают на то, что эта схема активно работает при мелкоклеточном раке легкого, однако, токсичность ее довольно высока, в связи с чем, необходимо определить оптимальные дозы для вышеуказанной комбинации.
Полученные данные указывают на то, что эта схема активно работает при мелкоклеточном раке легкого, однако, токсичность ее довольно высока, в связи с чем, необходимо определить оптимальные дозы для вышеуказанной комбинации.
Таблица №2.
Современная тактика лечения МРЛ
| Локализованный процесс | Распространенный процесс |
|
1. Химиотерапия Схема ЕР: этопозид + цисплатин Схема CAV: циклофосфамид+ доксорубицин+ винкристин 2. Лучевая терапия Ранняя одновременно с 1-м или 2-м курсом ХТ Поздняя — с 3-м курсом ХТ Суммарная доза ЛТ — 45 Гр 3. При наличии полной регрессии Проводится профилактическое облучение головного мозга — СОД 30 Гр |
1. Схемы EP, CAV или CDE (4-6 курсов) 2. Лучевая терапия Проводится на отдельные очаги поражения |
Иринотекан. Основываясь на результатах исследования II фазы Japan Clinical Oncology Group начали рандомизированное исследование III фазы JCOG-9511 по прямому сравнению двух схем химиотерапии цисплатин + иринотекан (PI) и цисплатин + этопозид (РЕ) у ранее нелеченных пациентов с МРЛ [27]. В первой комбинации доза иринотекана составила 60 мг/м2 в 1, 8-й и 15-й дни, цисплатина — 60 мг/м2 в 1-й день каждые 4 нед, во второй комбинации цисплатин вводили в дозе 80 мг/м2, этопозид — 100 мг/м2 в 1-3-й дни, каждые 3 нед. Всего в первой и второй группе было проведено по 4 курса химиотерапии. В работу планировалось включить 230 больных, однако, набор был остановлен после проведения предварительного анализа полученных результатов (n=154), так как выявлено достоверное увеличение выживаемости в группе, получающей лечение по схеме PI (медиана выживаемости равна 12,8 против 9,4 месяцев, соответственно). Однако следует отметить, что только 29% больных, рандомизированных в группу PI, смогли получить необходимую дозу препаратов. По данным этого исследования, схема PI была признана в Японии стандартом лечения локализованной формы МРЛ. В связи с небольшим количеством пациентов данные этой работы необходимо было подтвердить.
Однако следует отметить, что только 29% больных, рандомизированных в группу PI, смогли получить необходимую дозу препаратов. По данным этого исследования, схема PI была признана в Японии стандартом лечения локализованной формы МРЛ. В связи с небольшим количеством пациентов данные этой работы необходимо было подтвердить.
Поэтому в Северной Америке было начато исследование III фазы [32]. С учетом уже имеющихся результатов дозы препаратов были редуцированы. В схеме PI доза цисплатина составила 30 мг/м2 в 1-й день, иринотекана — 65 мг/м2 в 1-й и 8-й дни 3-недельного цикла. Что касается токсичности, то диарея IV степени не была зарегистрирована, предварительные данные по эффективности ожидаются.
Таксаны. В работе J.E. Smyth и соавт. проводилось изучение эффективности доцетаксела 100 мг/м2 в монотерапии у ранее леченных больных (n=28), объективная эффективность составила 25% [32].
В исследование ECOG включено 36 ранее нелеченных пациентов с МРЛ, которые получали паклитаксел 250 мг/м2в виде 24-часовой инфузии каждые 3 нед [14].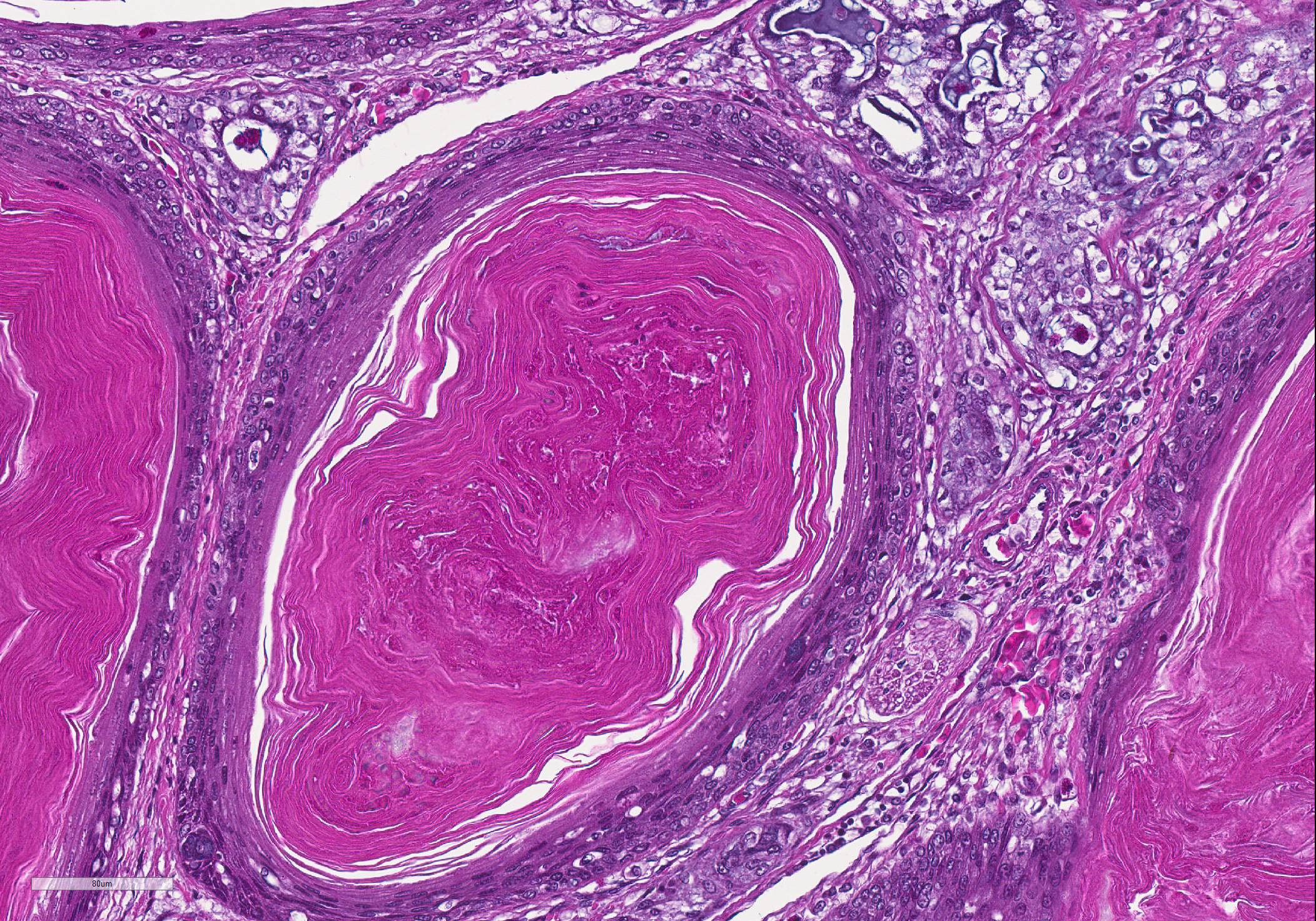 При этом уровень частичной регрессии составил 30%, в 56% случаев была зарегистрирована лейкопения IV степени. Однако интерес к этому цитостатику не ослабевал, в связи с чем, в США было начато Intergroup Study, где изучалась комбинация паклитаксела с этопозидом и цисплатином (ТЕР) или карбоплатином — (ТЕС) [26]. В первой группе химиотерапия проводилась по схеме ТЕР (паклитаксел 175 мг/м2 в 1-й день, этопозид 80 мг/м2 в 1-3-й дни и цисплатин 80 мг/м2 в 1-й день, при этом обязательным условием было введение колониестимулирующих факторов с 4-го по 14-й дни), в схеме РЕ дозы препаратов были идентичными. Более высокий уровень токсичности наблюдался в группе ТЕР, к сожалению, различий в медиане выживаемости не было получено (10,4 против 9,9 месяцев).
При этом уровень частичной регрессии составил 30%, в 56% случаев была зарегистрирована лейкопения IV степени. Однако интерес к этому цитостатику не ослабевал, в связи с чем, в США было начато Intergroup Study, где изучалась комбинация паклитаксела с этопозидом и цисплатином (ТЕР) или карбоплатином — (ТЕС) [26]. В первой группе химиотерапия проводилась по схеме ТЕР (паклитаксел 175 мг/м2 в 1-й день, этопозид 80 мг/м2 в 1-3-й дни и цисплатин 80 мг/м2 в 1-й день, при этом обязательным условием было введение колониестимулирующих факторов с 4-го по 14-й дни), в схеме РЕ дозы препаратов были идентичными. Более высокий уровень токсичности наблюдался в группе ТЕР, к сожалению, различий в медиане выживаемости не было получено (10,4 против 9,9 месяцев).
M. Reck и соавт. представили данные рандомизированного исследования III фазы, в котором в одной группе изучалась комбинация ТЕС (паклитаксел 175 мг/м2 в 4-й день, этопозид в 1-3-й дни в дозе 125 мг/м2 и 102,2 мг/м2пациентам с I-IIffi и IV стадией заболевания, соответственно, и карбоплатин AUC 5 в 4-й день), в другой группе — CEV (винкристин 2 мг в 1-й и 8-й дни, этопозид с 1го по 3-й день в дозе 159 мг/м2 и 125 мг/м2 больным с I- ШВ и IV стадией и карбоплатин AUC 5 в 1-й день) [28]. Медиана общей выживаемости составила 12,7 против 10,9 месяцев, соответственно, однако, полученные различия недостоверны (р=0,24). Уровень токсических реакций был приблизительно одинаков в обеих группах. По данным других исследований, аналогичных результатов не получилось, так что на сегодняшний день препараты таксанового ряда редко применяются при лечении мелкоклеточного рака легкого.
Медиана общей выживаемости составила 12,7 против 10,9 месяцев, соответственно, однако, полученные различия недостоверны (р=0,24). Уровень токсических реакций был приблизительно одинаков в обеих группах. По данным других исследований, аналогичных результатов не получилось, так что на сегодняшний день препараты таксанового ряда редко применяются при лечении мелкоклеточного рака легкого.
В терапии МРЛ исследуются новые направления лекарственного лечения, имеющие тенденцию к переходу от неспецифических лекарственных средств к так называемой таргетной терапии, направленной на определенные гены, рецепторы, ферменты. В ближайшие годы именно характер молекулярно-генетических нарушений будет определять выбор лекарственных схем лечения у больных МРЛ.
Таргетная терапия
Таргетная терапия aHmu-CD56. Известно, что клетки мелкоклеточного рака легкого экспрессируют CD56 [25]. Он экспрессируется периферическими нервными окончаниями, нейроэндокринными тканями, миокардом. Для подавления экспрессии CD56 были получены конъюгированные моноклональные антитела N901-bR. В I фазе исследования приняли участие пациенты (n=21) с рецидивом МРЛ, им в течение 7 дней проводилась инфузия препарата [31]. В одном случае была зарегистрирована частичная регрессия опухоли, длительность которой составила 3 мес. В работе British Biotech (I фаза) изучали моноклональные антитела mAb, которые конъюгируются в токсин DM1. DM1 ингибирует полимеризацию тубулина и микротрубочек, что приводит к смерти клетки. Исследования в этой области продолжаются.
Для подавления экспрессии CD56 были получены конъюгированные моноклональные антитела N901-bR. В I фазе исследования приняли участие пациенты (n=21) с рецидивом МРЛ, им в течение 7 дней проводилась инфузия препарата [31]. В одном случае была зарегистрирована частичная регрессия опухоли, длительность которой составила 3 мес. В работе British Biotech (I фаза) изучали моноклональные антитела mAb, которые конъюгируются в токсин DM1. DM1 ингибирует полимеризацию тубулина и микротрубочек, что приводит к смерти клетки. Исследования в этой области продолжаются.
Талидомид. Имеется мнение о том, что рост солидных опухолей зависит от процессов неоангиогенеза. С учетом роли неоангиогенеза в росте и развитии опухолей разрабатываются препараты, направленные на прекращение процессов ангиогенеза.
Например, талидомид был известен как лекарственное средство против бессонницы, который впоследствии перестал применяться в связи с наличием у него тератогенных свойств. К сожалению, механизм его антиангиогенного действия не известен, однако, талидомид блокирует процессы васкуляризации, индуцированные фактором роста фибробластов и эндотелиальным фактором роста [5]. Во II фазе исследования 26 больным с ранее нелеченным МРЛ было проведено 6 курсов стандартной химиотерапии по схеме РЕ, а затем в течение 2 лет они получали лечение талидомидом (100 мг в день) с минимальным уровнем токсичности [22]. У 2 пациентов зарегистрирована ПР, у 13 — ЧР, медиана выживаемости составила 10 мес, 1-летняя выживаемость — 42%. С учетом полученных многообещающих результатов решено начать исследования III фазы по изучению талидомида.
К сожалению, механизм его антиангиогенного действия не известен, однако, талидомид блокирует процессы васкуляризации, индуцированные фактором роста фибробластов и эндотелиальным фактором роста [5]. Во II фазе исследования 26 больным с ранее нелеченным МРЛ было проведено 6 курсов стандартной химиотерапии по схеме РЕ, а затем в течение 2 лет они получали лечение талидомидом (100 мг в день) с минимальным уровнем токсичности [22]. У 2 пациентов зарегистрирована ПР, у 13 — ЧР, медиана выживаемости составила 10 мес, 1-летняя выживаемость — 42%. С учетом полученных многообещающих результатов решено начать исследования III фазы по изучению талидомида.
Ингибиторы матриксной металлопротеиназы. Металлопротеиназы являются важными ферментами, участвующими в неоангиогенезе, основной их ролью является участие в процессах ремоделирования ткани и продолженного роста опухоли. Как выяснилось, инвазия опухоли, а также ее метастазирование зависят от синтеза и высвобождения этих ферментов опухолевыми клетками. Некоторые ингибиторы металлопротеиназ уже синтезированы и опробованы при мелкоклеточном раке легкого, как, например, маримастат (British Biothech) и BAY12-9566 (Bayer).
Некоторые ингибиторы металлопротеиназ уже синтезированы и опробованы при мелкоклеточном раке легкого, как, например, маримастат (British Biothech) и BAY12-9566 (Bayer).
В большом исследовании по изучению маримастата участвовало более 500 больных с локализованной и диссеминированной формами мелкоклеточного рака легкого, после проведения химиотерапии или химиолучевого лечения одной группе пациентов назначали маримастат (10 мг 2 раза в день), другой — плацебо [34]. Увеличения выживаемости получить не удалось. В работе по изучению BAY12-9566 в группе изучаемого препарата было отмечено уменьшение выживаемости, поэтому исследования ингибиторов металлопротеиназы при МРЛ были прекращены.
Также при МРЛ проводили изучение препаратов, ингибирующих рецепторы тирозинкиназы (гефитиниб, иматиниб) [17]. Только при исследовании иматиниба (гливек) были получены обещающие результаты, в связи с чем, продолжаются работы в этом направлении.
Таким образом, в заключение следует еще раз подчеркнуть, что в настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия. В этом обзоре представлены результаты некоторых исследований, в которых отражены данные химиотерапии и таргетной терапии. Таргетные препараты обладают новым механизмом действия, что дает основание надеяться на возможность более успешного лечения такого заболевания, как мелкоклеточный рак легкого.
С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия. В этом обзоре представлены результаты некоторых исследований, в которых отражены данные химиотерапии и таргетной терапии. Таргетные препараты обладают новым механизмом действия, что дает основание надеяться на возможность более успешного лечения такого заболевания, как мелкоклеточный рак легкого.
Литература
1. Бычков М.Б. Мелкоклеточный рак легкого. Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчиковой. — М., 2005. — P. 203-208.
2. Anzai H., Frost P., Abbuzzese J.L. Synergistic cytotoxicity with combined inhibition of topoisomerase (Topo) I and II // Proc.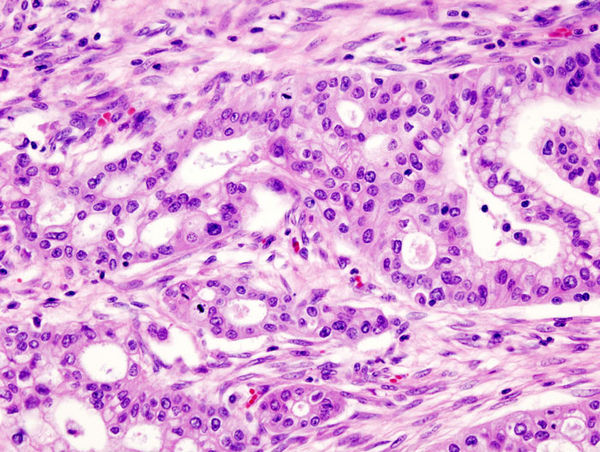 Amer. Assoc. Cancer. Res. — 1992. — Vol. 33. — P. 431.
Amer. Assoc. Cancer. Res. — 1992. — Vol. 33. — P. 431.
3. Ardizzoni A., Hansen H, Dombernowsky P. et al. Topotecan, a new active drug in the second-line treatment of small-cell lung cancer: a phase II study in patients with refractory and sensitive disease. The European Organization of Research and Treatment of Cancer Early Clinical Studies Group and New Drug Development Office, and the Lung Cancer Cooperative Group // J. Clin. Oncol. — 1997. — Vol. 15. — P. 2090-2096.
4. Auperin A., Arriagada R., PignonJP. et al. Prophylactic cranial irradiation for patients with non-small cell lung cancer in complete remission. Profilactic Cranial Irradiation Collaborative Group // New Engl. J. Med. — 1999. — Vol. 341. — P. 476-484.
5. Bauer KS, Dixon S.C., Figg W.D. et al. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species0dependent // Biochem. Pharmacol. — 1998. — Vol. 55. — P. 1827-1834.
6. Bleehen NM, Girling DJ, Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). I: survival and prognostic factors. Medical Research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1150-1156.
Bleehen NM, Girling DJ, Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). I: survival and prognostic factors. Medical Research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1150-1156.
7. Bleehen N.M., Girling D.J., Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). II: quality of life. Medical research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1157-1166.
8. Cormier Y., EisenhauerE, MuldalA et al. Gemcitabine is an active new agent in previously untreated extensive small cell lung cancer (SCLC). A study of National Cancer Institute of Canada Clinical Trials Group // Ann. Oncol. — 1994. — Vol. 5. — P. 283-285.
9. Cullen M, Morgan D, Gregory W. et al. Maintenance chemotherapy for anaplastic small cell carcinoma of the bronchus: a randomized, controlled trial // Cancer Chemother. Pharmacol. — 1986. — Vol. 17. — P. 157-160.
10. De Marinis F, Migliorino MR, Paoluzzi L. et al. Phase I/II trial of gemcitabine plus cisplatin and etoposide in patients with small-cell lung cancer // Lung Cancer. — 2003. — Vol. 39. — P- 331-338.
11. Depierrie A., von PawelJ., Hans K et al. Evaluation of topotecan (Hycamtin TM) in relapsed small cell lung cancer (SCLC). A multicentre phase Ii study // Lung Cancer. — 1997. — Vol. 18 (Suppl. 1). — P. 35.
12. Dowlati A, Levitan N., Gordon NH. et al. Phase II and pharmacokinetic/pharmacodynamic trial of sequential topoi- somerase I and II inhibition with topotecan and etoposide in advanced non-small-cell lung cancer // Cancer Chemother. Pharmacol. — 2001. — Vol. 47. — P. 141-148.
13. Eckardt J, Gralla R., Pallmer M.C. et al. Topotecan (T) as second-line therapy in patients with small cell lung cancer (SCLC): a phase II study // Ann. Oncol. — 1996. — Vol. 7 (Suppl. 5). — P. 107.
14. Ettinger DS, Finkelstein DM, Sarma RP. et al. Phase Ii study of paclitaxel in patients with extensive-disease small-cell lung cancer: an Eastern Cooperative Oncology Group study // J. Clin. Oncol. — 1995. — Vol. 13. — P. 1430-1435.
15. Evans W.K., Shepherd Fa, Feld R et al. VP-16 and cisplatin as first-line therapy for small-cell lung cancer // J. Clin. Oncol. — 1985. — Vol. 3. — P. 1471-1477.
16. Furuse K., Kubota K., Kawahara M. et al. Phase II study of vinorelbine in heavily previously treated small cell lung cancer. Japan Lung Cancer Vinorelbine Group // Oncology. — 1996. — Vol. 53. — P. 169-172.
17. Gamou S., Hunts J, Harigai H. et al. Molecular evidence for lack of epidermal growth factor receptor gene expression in small cell lung carcinoma cells // Cancer Res. — 1987. — Vol. 47. — P. 2668-2673.
18. Gridelli C., Rossi A., Barletta E. et al. Carboplatin plus vinorelbine plus G-CSF in elderly patients with extensive-stage small¬cell lung cancer: a poorly tolerated regimen. Results of a multicenter phase II study // Lung Cancer. — 2002. — Vol. 36. — P. 327-332.
19. Hainsworth JD, Burris III HA, ErlandJB. et al. Combination chemotherapy with gemcitabine and vinorelbine in the treatment of patients with relapsed or refractory small cell lung cancer: a phase II trial of the Minnie Pearl Cancer Research Network // Cancer. Invest. — 2003. — Vol. 21. — P. 193-199.
20. James L.E., Rudd R., Gower N. et al. A phase III randomized comparison of gemcitabine/carboplatin (GC) with cisplatin/ etoposide (PE) in patients with poor prognosis small cell lung cancer (SCLC) // Proc. Amer. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1170.
21. Jassem J., Karnicka-Mlodkowska H., van Pottelsberghe C. et al. Phase II study of vinorelbine (Navelbine) in previously treated small cell lung cancer patients. EORTC Lung Cancer Cooperative Group // Europ. J. Cancer. — 1993. — Vol. 29A. — P. 1720-1722.
22. Lee SM.,JamesLE,Mohmmaed-Ali V. et al. A phase II study of carboplatin/etoposide with thalidomide in small cell lung cancer (SCLC) // Proc. Amer. Soc. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1251.
23. Lowebraun S., BartolucciA., Smalley RV. et al. The superiority of combination chemotherapy over single agent chemo¬therapy in small cell lung cancinoma // Cancer. — 1979. — Vol. 44. — P. 406-413.
24. Mackay HJ, O’Brien M, Hill S. et al. A phase II study of carboplatin and vinorelbine in patients with poor prognosis small cell lung cancer // Clin. Oncol. — (R. Coll. Radiol.). — 2003. — Vol. 15. — P. 181-185.
25. Moolenaar CE, Muller EJ., Schol DJ. et al. Expression of neural cell adhesion molecule-related sialoglycoprotein in small cell lung cancer and neuroblastoma cell lines H69 and CHP-212 // Cancer. Res. — 1990. — Vol. 50. — P. 1102-1106.
26. Niell H.B., Herndon J.E., Miller AA et al. Final report of a randomized phase III Intergroup trial of etoposide (VP-16) and cisplatin (DDP) with or without paclitaxel (TAX) and G-CSP in patients with extensive stage small cell lung cancer (ED-SCLC) // Lung Cancer. — 2003. — Vol. 41 (Suppl. 2). — S. 81.
27. Noda K., Nishiwaki Y., KawaharaM. et al. Irinitecan plus cisplatin compared with etiposide plus cisplatin for extensive small-cell lung cancer // New Engl. J. Med. — 2003. — Vol. 346. — P. 85-91.
28. Reck M, von Pawel J., Macha HN. et al. Randomized phase III trial of paclitaxel etoposide, and carboplatin versus carboplatin, and vincristine in patients with small-cell lung cancer // J. Natl. Cancer. Inst. — 2003. — Vol. 95. — P. 1118-1127.
29. Rinaldi D., Lorman N., BrierreJ. et al. A phase I-II trial of topotecan and gemcitabine in patients with previously treated, advanced non-small cell lung cancer (LOA-3) // Cancer. Invest. — 2001. — Vol. 19. — P 467-474.
30. Rinaldi D., Lorman N., Brierre J. et al. A phase II trial of topotecan and gemcitabine in patients with previously treated, advanced nonsmall cell lung carcinoma // Cancer. — 2002. — Vol. 95. — P. 1274-1278.
31. Roy D.C., Ouellet S., Le Houillier et al. Elimination of neuroblastoma and small-cell lung cancer cells with an antineural cell adhesion molecule immunotoxin // J. Natl. Cancer. Inst. — 1996. — Vol. 88. — P. 1136-1145.
32. Sandler A, Langer C., BunnJrPA. et al. Interim safety analysis of irinotecan and cisplatin combination chemotherapy for previously untreated extensive small cell lung cancer // Proc. Amer. Soc. Clin. Oncol. — 2003. — Vol. 22. — Abstr. 2537.
33. Seifter EJ, Ihde D.C. Therapy of small cell lung cancer: a prospective on two decades of clinical research // Semin. Oncol. — 1988. — Vol. 15. — P. 278-299.
34. Shepherd FA, Giaccone G, Seymour L. et al. Prospective, randomized, double-blind, placebo-controlled trial of marim- astat after response to first-line chemotherapy in patients with small-cell lung cancer: a trial of national Cancer. Institute of Canada — Clinical Trials Group and European Organization for Research and Treatment of Cancer // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4434-4439.
35. Smith I.E, Evans BD. Carboplatin (JM8) as a single agent in combination in the treatment of small cell lung cancer // Cancer. Treat. Rev. — 1985. — Vol. 12 (Suppl. A). — P. 73-75.
36. Smyth JF, Smith IE, Sessa C. et al. Activity of docetaxel (Taxotere) in small cell lung cancer. The Early Clinical Trials Group of EORTC // Europ. J. Cancer. — 1994. — Vol. 30A. — P. 1058-1060.
37. Spiro S.G., Souhami RL, Geddes D.M. et al. Duration of chemotherapy in small cell lung cancer: a Cancer Research Campaign trial // Brit. J. Cancer. — 1989. — Vol. 59. — P. 578-583.
38. Sundstrom S., Bremenes RM, Kaasa S. et al. Cisplatin and etoposide regimen is superior to cyclophosphamide. Epirubi- cin, and vincristine regimen in small-cell lung cancer: results from randomized phase III trial with 5 year’follow-up // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4665-4672.
39. von PawelJ., DepierreA., Hans K. et al. Topotecan (Hycamtin TM) in small cell lung cancer (SCLC) after failure of first line therapy: multicentre phase II study // Europ. J. Cancer. — 1997. — Vol. 33. (Suppl. 8). — P. S229.
40. von Pawel J, Schiller J.H., Shepherd FA et al. Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer // J. Clin. Oncol. — 1999. — Vol. 17. — P. 658-667.
41. Wu AH, Henderson B.E., Thomas D.C. et al. Secular trends in histologic types of lung cancer // J. Natl. Cancer. Inst. — 1986. — Vol. 77. — P. 53-56.
Поступила в редакцию 16.11.2005 г.
Плоскоклеточный рак кожи — Docrates
Факторы риска плоскоклеточного рака кожи
Солнечное УФ-излучение является причиной 60-90% случаев заболевания раком кожи. Солнечные ожоги, а также, например, постоянное пребывание на солнце в связи с работой на открытом воздухе, повышают риск злокачественных опухолей. Факторами риска развития плоскоклеточного рака также являются: воздействие мышьяка, лучевая и химиотерапия, а также медикаментозное лечение, ослабляющее иммунитет, и наследственность (генетическая предрасположенность).
Симптомы плоскоклеточного рака кожи
Если на коже появилось красноватое круглое пятно, в некоторых случаях покрытое сухими шелушащимися чешуйками, то это может означать предраковое заболевание, солнечный (актинический) кератоз. Чаще всего признаком ранней стадии плоскоклеточного рака является появление поверхностной корки, под которой четко просматривается язва, свидетельствующая о разрушении базальной мембраны. Обнаруживается новообразование, как правило, 1-3 см в диаметре, однако если его не лечить, то плотная бляшка увеличивается в размерах и проникает в более глубокие слои кожи.
Диагностика плоскоклеточного рака кожи
Для выявления основных видов рака кожи достаточно визуального осмотра и специальных инструментов не требуется, но для подтверждения диагноза может быть проведена дерматоскопия (визуальный метод исследования кожных новообразований). Пациенты, как правило, самостоятельно обнаруживают подозрительные изменения кожи и по этой причине обращаются к врачу. Для выявления плоскоклеточного рака важно ознакомиться с историей болезни, узнать, как давно появилось новообразование на коже, увеличилось ли оно в размерах и какой дозе облучения подвергался пациент. При необходимости для подтверждения диагноза берется образец ткани на анализ.
Лечение плоскоклеточного рака кожи
Основным методом лечения плоскоклеточного рака является операция. К лучевой терапии прибегают гораздо реже. Если опухоль успела распространиться на другие ткани или находится в трудном для лечения месте, например, на губе или веке, то во время операции зачастую требуется пересадка кожи. Если болезнь находится уже на поздней стадии, то может понадобиться лечение противоопухолевыми препаратами.
Мелкоклеточный рак легкого | Лечение в Москве на системе Кибер-Нож
Лечение мелкоклеточного рака легкого является одним из направлений деятельности Центра лучевой терапии проекта «ОнкоСтоп». Мы используем в своей работе самые современные методы, а также гарантируем индивидуальный подход к каждому пациенту и демократичную ценовую политику.
У нас осуществляется лечение данного заболевания при помощи системы «КиберНож», относящейся к радиохирургии.
Симптомы мелкоклеточного рака легкого
Мелкоклеточный рак почки на ранних стадиях протекает бессимптомно. Наиболее распространенные признаки данного заболевания появляются на более поздней стадии. К ним относится:
- гематурия,
- боли в поясничной области,
- прощупывание опухоли,
- повышение артериального давления.
Диагностика мелкоклеточного рака легкого
К наиболее эффективным методам диагностики данного заболевания относится:
- рентгенологическое исследование,
- флюорография,
- микроскопия мокроты,
- компьютерная томография,
- бронхоскопия.
Лечение мелкоклеточного рака
Как и для других видов рака, для лечения мелкоклеточного рака используются три основных метода:
- оперативное вмешательство,
- лучевая терапия,
- химиотерапия.
Как правило, оперативное вмешательство показано больным МРЛ на ранних этапах.
Лучевая терапия может обеспечить существенный регресс опухоли в 70 % случаев, но, как и в случае с оперативным лечением, облучение не эффективно при использовании в монорежиме, так как это не препятствует образованию отдаленных метастазов.
Химиотерапия представляет наиболее действенный метод лечения мелкоклеточного рака легкого. Наилучшие результаты достигаются от одновременного применения нескольких — 2-3-х, реже – 4-х и более активных препаратов. Подобные комбинации препаратов называются полихимиотерапией.
На выбор терапевтического лечения мелкоклеточного рака легкого влияет в первую очередь распространенность ракового процесса. Существует две формы заболевания — локализованная и распространенная.
Локализованная форма мелкоклеточного рака легкого хорошо поддается лечению. Статистика результатов ее лечения данной формы МРЛ имеет следующие показатели:
- эффективность лечения – в 65-90 % случаев,
- регресс опухоли — в 45-75 % случаев,
- двухлетняя выживаемость составляет 40-50 %;
- пятилетняя выживаемость составляет около 10%.
Проведение химиотерапии в 2-4 курса является основой в лечении локализованной формы МРЛ. Лучевую терапию следует начинать на фоне химиотерапии: либо во время, либо после 1-2 курсов. Если у больного наблюдается полная ремиссия, целесообразно проведение облучения головного мозга. Это необходимо и потому, что МРЛ отличается высокой вероятностью, порядка 70%, метастазирования в головной мозг.
Больным распространенным МЛР предписано лечение посредством комбинированной химиотерапии. В данном случае облучение целесообразно производить только при наличии таких показаний, как при метастатическом поражении:
- костей,
- головного мозга,
- надпочечников,
- лимфатических узлов,
- средостения наряду со сдавливанием верхней половой вены.
МРЛ довольно хорошо поддается лечению лучевой терапией и химиотерапией, но чувствительность к лечению нередко нивелируется высоким уровнем возникающих рецидивов. Поэтому пациентам, которым по медицинским показаниям отказано в проведении хирургической операции, назначается классическая лучевая терапия, которая, в свою очередь, не позволяет провести эскалацию дозы из-за побочных эффектов.
Гипофракционированная стереотаксическая лучевая терапия, представленная на российском рынке новейшей высокотехнологичной разработкой — радиохирургической роботизированной системой КиберНож. Она позволяет увеличить суммарную дозу на патологический очаг и, как следствие, увеличить вероятность локального контроля опухоли и выживаемость пациентов.
КиберНож позволяет проводить стереотаксическую радиохирургию опухолевых образований без ограничения дыхания пациента. Система слежения за дыханием Synchrony синхронизирует движение робота с дыханием пациента, и, соответственно, с движением мишени. Погрешность позиционирования мишени при такой работе системы снижается до 1 (!) мм.
Субмиллиметровая точность «КиберНож», с одной стороны, уменьшает нагрузку на окружающие здоровые ткани, с другой — позволяет произвести эскалацию дозы на мишень, увеличив, таким образом, терапевтическое отношение.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
Подробную информацию о лечении мелкоклеточного рака легкого на системе «КиберНож» Вы можете получить у наших специалистов Центра лучевой терапии проекта «ОнкоСтоп» по телефону +7 (495) 215-00-49.
| Стоимость лечения | |
| Рак легкого (от 370 000) |
Точная стоимость лечения определяется только после консультации с врачом
Рак кожи — лечение в Москве
Базалиома
Базалиома (базальноклеточный рак) – злокачественное образование, развивающееся из клеток базального слоя кожи.
Как правило, базалиому зачастую принимают за обычную родинку, поскольку выглядит она как небольшое, слегка выпуклое образование (диаметром всего в несколько миллиметров). Но, в отличие от родинки, в центре базалиомы, как правило, находится небольшая «ямка» с корочкой. Если эту корочку убрать, то начинает развиваться эрозия, переходящая со временем в язву. Даже если язва зарубцуется, рак продолжает свой рост «вширь».
Чаще всего рак развивается на открытых участках кожи – лице, голове, шее.
Основные разновидности базалиомы:
- Узелковая. Образование похоже на «узелки» небольшого размера;
- Язвенная. Поверхность базалиомы постоянно нарушается, что приводит к появлению язв.;
- Пигментная. В этом случае базалиома (целиком или в части опухоли) имеет черный или темно-кориченевый цвет;
- Бородавчатая. Эта форма опухоли похожа на цветную капусту – одно образование словно «слеплено» из нескольких узлов.
Образование этого типа растет достаточно медленно и не дает метастазы. Но даже в этом случае необходимо своевременное лечение, поскольку отсутствие терапии может привести к достаточно серьезному поражению кожи. В некоторых случаях базалиома прорастает внутрь и разрушает подлежащие хрящевые и костные ткани.
Почему возникает базалиома?
Основной причиной развития базалиомы является длительный контакт с ультрафиолетом (солярий, солнечные ванны и т.д.). Также повлиять на появление рака могут:
- Ионизирующее излучение;
- Химические канцерогены;
- Генетическая предрасположенность;
- Сниженный иммунитет.
Как правило, при прочих равных условиях больше всего рискуют заполучить базалиому светлокожие и голубоглазые люди, любители загара, люди после 50 лет.
Лечение базалиомы
Выбор метода лечения рака кожи зависит от таких факторов, как вид, размер и локализация опухоли, степень прорастания в ткани, наличия сопутствующих заболеваний.
Основным методом лечения базалиомы является ее удаление различными техниками:
- Хирургическое. Ткани иссекаются до окончания пораженного участка (или с заходом на здоровые). Операция проводится под местной анестезией;
- Криодеструкция. Показана при образованиях, расположенных только на поверхности кожи. Проводится при помощи жидкого азота;
- Лазерное. Очень эффективный метод, дающий хороший косметический эффект.
Если расположение базалиомы не дает осуществить хирургическое лечение (например, около глаза), проводится лучевая терапия. Этот вид лечения весьма эффективен, поскольку ткань опухоли очень чувствительна к излучению.
Профилактика базалиомы
Чтобы не допустить развитие базалиомы, нужно не злоупотреблять загаром (как в солярии, так и на открытом воздухе), осторожно обращаться с веществами, в состав которых входят канцерогены.
И обязательно осматривайте свои «родинки» (особенно, если вы голубоглазый любитель загара, работающий на вредном производстве), любое изменение и длительное покраснение на коже, «содранная» болячка могут стать началом развития опухоли.
Плоскоклеточный рак у собак и кошек
Плоскоклеточный рак — это часто встречающееся злокачественное новообразование у собак и кошек, возникающее из кератиноцитов (клеток кожи). Основная причина не всегда очевидна. Чаще всего наблюдается в географических районах, характеризующихся длительными периодами интенсивного пребывания на солнце. Редко сообщалось, что плоскоклеточный рак возникает из-за ожоговых рубцов, хронических инфекционных процессов и хронической дискоидной волчанки (у собак). Папилломавирусы как собак, так и кошек могут провоцировать развитие плоскоклеточной карциномы.
У собак. Плоскоклеточный рак является вторым наиболее распространенным типом рака ротовой полости у собак, после меланомы и на его долю приходится примерно 5% всех опухолей кожи собак. Наиболее распространенные зоны риска для ПКР находятся во рту, языке, миндалинах и деснах. Когда заболевание формируется на коже собаки, оно чаще всего проявляется в областях, где либо отсутствует шерсть, либо в областях, где отсутствует пигмент. Ногтевое ложе является еще одним распространенным местом для развития ПКР у собак.
Этот вид новообразований может развиться в любом возрасте или у любой породы собак, но с возрастом риск развития заболевания увеличивается, в основном болеют животные старше 9 лет. Что касается пород, боксеры, пудели и пекинесы предрасположены к этому заболеванию, но породы с белым или палевым окрасом и цветом кожи, или, естественно, короткошерстными, больше всего подвержены солнечно-индуцированной плоскоклеточной карциноме. Наиболее распространенным признаком является видимая приподнятая одиночная опухоль или поражение. Повреждение обычно изъязвлено и легко кровоточит.
У кошек. Плоскоклеточный рак является наиболее распространенным типом рака ротовой полости и четвертым наиболее распространенным типом рака кожи у кошек. Кошки имеют тенденцию к развитию этого заболевания на висках, на внешних кончиках ушей, кончике носа, на веках и на губах. Когда он образуется во рту, то чаще всего поражает десна. Кошки могут также страдать от плоскоклеточной карциномы внутренних органов, чаще всего легких или печени, но этот тип ПКР встречается редко.
Как и плоскоклеточная карцинома у собак, эта болезнь обычно поражает кошек в возрасте девяти лет и старше. Развивается у самцов и самок в равной степени, и у него нет склонности к породе — хотя у белой кошки вероятность развития рака кожи в тринадцать раз выше в результате повышенной восприимчивости к повреждениям от солнца. Опухоли у кошек выглядят аналогично опухолям, обнаруженным у собак, за одним исключением — около 45% всех пораженных кошек имеют тенденцию иметь более одной опухоли на месте.
Если вы заметили похожее повреждение у вашей кошки или собаки, то вам следует немедленно отнести их к ветеринару. Хотя ПКР, как правило, является локально инвазивным и медленно растущим заболеванием, оно является серьезным и нуждается в лечении как можно раньше. Чем раньше поставлен диагноз, тем лучше прогноз. Диагноз обычно ставится с помощью биопсии кожи, но врачу так же могут потребоваться анализы крови, общий анализ мочи, рентген и компьютерная томография, для исключения распространения заболевания.
Плоскоклеточный рак лечат различными способами, причем выбор метода зависит от места и прогрессирования заболевания. В некоторых случаях рекомендуется хирургическое удаление поражения. В других случаях может использоваться криотерапия или электрохирургия. Химиотерапия и / или лучевая терапия также используются для предотвращения распространения заболевания, но реже. После лечения животное обычно испытывает дискомфорт, поэтому ветеринарный врач может назначить обезболивающие препараты. Важно следовать предписаниям вашего ветеринара для введения обезболивающего, чтобы избежать любого риска передозировки.
Наиболее эффективный способ защитить вашего питомца от развития плоскоклеточной карциномы — минимизировать время, которое они проводят под прямыми солнечными лучами, особенно между 10:00 и 14:00. Если ваша кошка или собака любит лежать на солнце рядом с дверью или окном, рассмотрите возможность нанесения на стекло УФ-светоотражающей пленки или установки оконной шторы, чтобы предотвратить попадание ультрафиолетовых лучей. Нанесение небольшого количества солнцезащитного крема на кончики ушей вашей кошки также поможет защитить ее, когда она на улице.
Раннее обращение к ветеринарному врачу, увеличивает вероятность полного излечения животного, даже при таком серьезном диагнозе.
Ветеринарный врач СВК «Свой Доктор»
Филиал Дзержинский
Калевская Я.Ф.
Гетерогенность опухоли и межклеточные сети карциномы носоглотки при одноклеточном разрешении
Панорамный вид клеточного состава при биопсии опухоли и PBMC у пациентов с NPC
Чтобы пролить свет на сложность микроокружения опухоли (TME) в NPC, мы выполнили одно- секвенирование клеточной РНК в сочетании с секвенированием репертуара TCR на жизнеспособных клетках, полученных из биопсии опухоли, и сопоставленных мононуклеарных клетках периферической крови (PBMC) у 10 пациентов с EBV-положительным NPC до любого противоракового лечения (рис.1a, дополнительный рисунок 1a, b и дополнительная таблица 1). В среднем мы получили более 380 миллионов считываний секвенирования для каждого образца, при этом медиана насыщения секвенирования (покрывающая долю сложности библиотеки) составила 90,75% (75,90–94,50%; дополнительная таблица 2). После фильтров строгого контроля качества (низкая экспрессия репрезентативных генов и предполагаемых дублетов; см. Методы; дополнительный рисунок 1c и дополнительную таблицу 3), в общей сложности было идентифицировано 176 447 клеток у 10 пациентов (включая 82 622 и 93 825 для опухолей и PBMC, соответственно. ; Дополнительные данные 1).Мы получили около 1500 генов и 4950 уникальных молекулярных идентификаторов (UMI) в среднем для каждой клетки, что указывает на достаточный охват и репрезентативность транскриптов (дополнительный рис. 1d и дополнительные данные 1).
Рис. 1: Ландшафтный профиль отдельных клеток в опухолях NPC и соответствующих PBMC.a Схема экспериментальной схемы подчеркивает общий план исследования. Отдельные жизнеспособные клетки собирали с помощью сортировки с помощью проточной цитометрии (FACS) и подвергали клеточному штрих-кодированию.Библиотеки кДНК экспрессии 5’-мРНК и TCR были сконструированы независимо с последующим высокопроизводительным секвенированием и последующим анализом. b График UMAP 176 447 отдельных клеток, сгруппированных в шесть основных типов клеток (левая панель), и нормализованная экспрессия маркерных генов для каждого типа клеток (правая панель). Каждая точка представляет одну отдельную ячейку, окрашенную в соответствии с типом ячейки (левая панель), а глубина цвета от серого до синего представляет выраженность от низкой до высокой (правая панель). c График UMAP для указанных выше отдельных клеток, окрашенных в соответствии с их происхождением из периферической крови или опухоли (левая панель), и доли типов клеток, происходящих от каждого пациента (правая панель).Каждая точка представляет одну отдельную ячейку, окрашенную в соответствии с исходной точкой отсчета.
Затем, чтобы определить группы клеток со сходными профилями экспрессии, мы выполнили неконтролируемый кластерный анализ, реализованный в программном обеспечении Seurat 19 . Распределение кластеров клеток для каждого пациента хорошо соответствовало таковому у других пациентов, предполагая, что потенциальные вариации экспрессии из-за пакетного эффекта обработки образцов были минимальными (см. Методы; Дополнительный рис. 1e). Каждый кластер далее идентифицировали как специфическую клеточную субпопуляцию в соответствии с экспрессией наиболее вариабельных генов и канонических маркеров, включая CD4 + Т-клетки (генные маркеры: PTPRC , CD3D и CD4 ), CD8 + Т-клетки ( PTPRC , CD3D и CD8A ), миелоидные клетки ( CD14 , ITGAX для CD11C), злокачественные клетки ( EPCAM и KRT5 ), В-клетки ( CD19 и MS4A1 ) и NK-клетки ( FCGR3A и NCAM1 ; рис.1б). Кроме того, мы обнаружили 56 фибробластов и семь эндотелиальных клеток с редким распределением среди TME-клеток (дополнительный рис. 1f), что может отражать их внутреннюю природу в NPC или их низкую представленность из-за технических ограничений. Все эти типы клеток широко распространены в образцах опухолей, что указывает на гетерогенный клеточный состав TME в NPC (рис. 1b), что согласуется с недавним исследованием одноклеточного транскриптома NPC 17 . Мы заметили, что пропорции CD8 + Т- и В-клеток увеличились на 1.В среднем в 34 и 2,33 раза соответственно, в то время как количество NK-клеток было уменьшено в опухолях по сравнению с PBMC, что свидетельствует о двух различных иммунных ландшафтах между опухолью и периферической кровью (рис. 1c). Кроме того, мы сравнили состав клеток между NPC и другими типами рака с общедоступными одноклеточными данными, включая немелкоклеточный рак легкого (NSCLC), колоректальный рак (CRC) и протоковую аденокарциному поджелудочной железы (PDAC). Мы наблюдали частое появление инфильтрирующих иммунных клеток на фоне индивидуальной неоднородности клеточного состава при всех типах рака (дополнительный рис.1г). Примечательно, что мы наблюдали значительно более высокую долю Т-клеток в NPC по сравнению с любыми другими видами рака (дополнительный рис. 1h), что согласуется с предыдущим выводом о том, что лейкоциты, инфильтрирующие опухоль, были основной характеристикой стромы NPC 20 .
Неоднородность Т-клеток и разнообразие репертуара TCR
Учитывая обилие Т- и NK-клеток в образцах опухолей NPC и их противоопухолевые возможности, мы исследовали внутреннюю структуру и потенциальные функциональные подтипы общей популяции T- и NK-клеток. .Мы сгруппировали все 141875 Т- и NK-клеток в 32 подгруппы, используя кластерный анализ, большинство из которых составляли Т-клетки CD4 + и CD8 + (рис. 2а, дополнительный рисунок 2а, дополнительные данные 1 и 2). Чтобы идентифицировать любой ген с определенной экспрессией на типе клеток, мы выполнили анализ дифференциальной экспрессии генов (DEG) кластеров Т-клеток. Мы наблюдали, что кластеры Т-клеток CD4 + и CD8 + в образцах опухолей имели широко распространенную сверхэкспрессию маркеров истощения ( LAG3 , TIGIT , PDCD1 , HAVCR2 и CTLA4 ) и эффекторных молекул ( GZMB , GZMK , INFG , NKG7 , GNLY и IL2 ; дополнительный рис.2b), с чрезвычайно высокой экспрессией пролиферативных сигнатур для CD8_C10_MKI67 и Treg_C3_MKI67 (дополнительный рисунок 2c и дополнительные данные 3). Совместная экспрессия генов истощения и эффекторов в Т-клетках, инфильтрирующих опухоль, также недавно была продемонстрирована в NPC 17 . Вместе эти наблюдения предполагают, что Т-клетки проявляли противоопухолевые эффекты против антигенов, но их эффекторные функции каким-то образом подавлялись в TME NPC. Напротив, мы наблюдали сигнатуры наивных генов (высокая экспрессия TCF7 , SELL , CCR7 и LEF1 ) в покоящихся Т-клетках в PBMC, включая CD4_C1_LEF1, CD8_C1_LEF1, CD8_C2_TCF7 и DN_LEF1 (CD4 CD8 — ) кластеров ячеек и частично в Treg_C1_SELL и DP_TCF7 (CD4 + CD8 + ; дополнительный рис.2б). Кроме того, мы идентифицировали два кластера CD4 + Th2-подобных клеток в опухолях, включая Th2_like_C1_CCR7 и Th2_like_C2_TNF, со специфической экспрессией наивных маркеров Т-клеток и провоспалительных цитокинов, соответственно, а также с общей экспрессией Th2-подобных клеток. маркеры 21 ( CXCL13 , BHLHE40 и CXCR3 ; дополнительный рисунок 2d).
Рис. 2: Профиль экспрессии и развитие Т-клеток CD8 + .график UMAP для 141 875 T- и NK-ячеек, сгруппированных в 32 типа ячеек.Каждая точка представляет собой ячейку, окрашенную в соответствии с типами ячеек, указанными в правой легенде. b Графики скрипки показали нормализованную экспрессию маркеров Т-клеток CD8 + (строки) в каждом кластере Т-клеток CD8 + (столбцы). Клеточные кластеры и уровень экспрессии гена указаны на осях x и y соответственно. c Анализ псевдовременной траектории выбранных CD8 + Т-клеток (CD8_C5, CD8_C7, CD8_C8, CD8_C9, CD8_C10 и CD8_C11; n = 10000) с генами с высокой вариабельностью.Каждая точка представляет одну отдельную ячейку, окрашенную в соответствии с ее меткой кластера. На входном графике каждая ячейка показывала псевдовременную оценку от темно-синего до желтого, что указывало на раннее и конечное состояния, соответственно. Для кластеров Т-клеток CD8 + для анализа случайным образом были выбраны 10000 клеток. d Графики в виде прямоугольников показали показатели индекса перехода истощенных Т-клеток CD8 + (CD8_C11_PDCD1) и других Т-клеток CD8 + ( n = 10). Сравнение проводилось с использованием двустороннего теста Вилкоксона.Кластеры ячеек и оценки индекса перехода указаны на осях x и y соответственно. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1,5-кратный межквартильный размах; цветные точки обозначают каждого пациента. e Графики в виде прямоугольников показали оценки расширения (верхняя панель) и индекса миграции опухоли PBMC (нижняя панель) для каждого кластера Т-клеток CD8 + ( n = 10). Каждое сравнение проводилось с использованием двустороннего теста Вилкоксона (верхняя панель) или теста Краскела – Уоллиса (нижняя панель).Клеточные кластеры указаны на оси x , а ось y показывает оценки индекса расширения и миграции опухоли PBMC на верхней и нижней панели, соответственно. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1,5-кратный межквартильный размах; цветные точки обозначают каждого пациента.
Затем мы выполнили анализ репертуара Т-клеточных рецепторов (TCR) на основе последовательностей α- и β-цепей TCR, который выявил 38720 (32,97%; из 117 447) Т-клеток с детектируемыми TCR α-β парами или клонотипами после строгой проверки. контроль качества (дополнительный рис.2e и дополнительные данные 4). Мы не наблюдали совместного использования какого-либо идентичного клонотипа TCR у разных пациентов с NPC, хотя у них были определенные предпочтения в отношении фрагментов V и J, а также пар V — J (дополнительный рис. 3a, b). Интересно, что мы наблюдали совместное использование наиболее вариабельных последовательностей CDR3 в образцах пациентов (дополнительный рис. 3b), среди которых CAVRGTGTASKLTF и CASSFSGANVLTF были связаны с распознаванием антигенов MLANA и EBV в базе данных VDJ 22 соответственно (дополнительный рисунок). Таблица 4).Более того, мы наблюдали, что как CD4 + , так и CD8 + Т-клетки имеют больше клональных Т-клеток, которые происходят из идентичных клонотипов TCR и согласуются с предыдущим исследованием 17 , в опухолях по сравнению с PBMC, предполагая клональная экспансия определенных доминантных клонов Т-клеток, инфильтрирующих опухоль, при непрерывной стимуляции опухолевыми антигенами (дополнительный рис. 3c).
Разнообразие CD8
+ T-клеток и развитие истощенных внутриопухолевых CD8 + T-клетокМы идентифицировали в общей сложности 62 244 CD8 + T-клеток во всех образцах NPC, которые были сгруппированы в 11 кластеров на основе их экспрессия канонических маркеров, включая два наивных маркера (CD8_C1_LEF1 и CD8_C2_TCF7), центральную память крови (CD8_C3_KLRB1), эффекторную память крови (CD8_C4_KLRG1), высокую миграцию (CD8_C5_CX3CR1), эффекторную память опухоли (CD7_RC8_C8_C8_C8_C8_C8_C8_C8_C8_ резидентные ткани памяти (CD8_C9_XCL1), высокопролиферирующие (CD8_C10_MKI67) и истощенные (CD8_C11_PDCD1) Т-клетки (рис.2а, б, дополнительные данные 1 и 2). Большинство (> 97,68%) из CD8_C6_IL7R, CD8_C7_GZMK, CD8_C8_MHC, CD8_C9_XCL, CD8_C10_MKI67 и CD8_C11_PDCD1 были найдены в опухолях NPC, тогда как большинство (> 94,85%) из CD8_C1_LEF1, CD8_C2_TCF7, CD8_C3_KLRB1, CD8_C4_KLRG1 и CD8_C5_CX3CR1 были в периферической крови (Дополнительные данные 1).
Чтобы оценить функциональное состояние Т-клеток CD8 + , мы рассчитали баллы цитотоксичности, пролиферации и истощения для всех кластеров Т-клеток CD8 + .Мы наблюдали самую высокую оценку цитотоксичности для CD8_C5_CX3CR1, самую высокую оценку пролиферации для CD8_C10_MKI67 и самую высокую оценку истощения для CD8_C11_PDCD1 (дополнительные рис. 2c и 4a), что указывает на их потенциальную цитотоксичность, пролиферацию и истощение функций соответственно. Затем анализ DEG выявил высокую экспрессию рецепторов хемокинов ( CX3CR1 , CXCR1 и CXCR2 ), рецепторов S1P ( S1PR1 , S1PR4 и S1PR5 ) и интегринов ( ITGB2 , ITGA4 , ITGAL и ITGB7 ) в CD8_C5_CX3CR1, которые отвечали за регуляцию миграции Т-клеток CD8 + 23 (дополнительный рис.4б). Более того, анализ обогащения сигнального пути генов с дифференциальной экспрессией показал, что опухолевые цитотоксические CD8 + Т-клеточные кластеры (CD8_C7_GZMK, CD8_C8_MHC и CD8_C9_XCL1) были обогащены путями, связанными с продукцией цитокинов и активацией лимфоцитов; и CD8_C5_CX3CR1 был обогащен путями, связанными с трансэндотелиальной миграцией лейкоцитов и миграцией лейкоцитов (дополнительный рис. 4c), что согласуется с их способностью к периферическому кровообращению и инфильтрации в опухоль 24 .
Для дальнейшего изучения развития Т-клеток CD8 + в NPC, мы сначала выполнили анализ псевдовременной траектории с использованием Monocle2, чтобы упорядочить каждую Т-клетку CD8 + вдоль траекторий в соответствии с их профилями экспрессии и перехода. Мы наблюдали траектории развития от клеток CD8_C5_CX3CR1 в начальном состоянии или клеток CD8_C10_MKI67 в промежуточном состоянии до клеток CD8_C11_PDCD1 в терминальном состоянии (рис. 2c). В качестве подтверждения, по сравнению с истощенным CD8_C11_PDCD1, CD8_C10_MKI67 имел промежуточную оценку истощения (дополнительный рис.4a) и более низкая экспрессия известных маркеров истощения, включая PDCD1 , LAG3 и HAVCR2 (дополнительный рис. 2b). Секвенирование репертуара TCR выявило 21 099 CD8 + Т-клеток (из 62 244) с клонотипами TCR (дополнительный рисунок 4d и дополнительные данные 4). Мы наблюдали, что CD8_C11_PDCD1 разделяет значительные доли идентичных TCR с другими кластерами Т-клеток CD8 + , в диапазоне от 17,68% до 41,67% для инфильтрации кластеров Т-клеток и 5.31% для периферийного CD8_C5_CX3CR1 (дополнительный рисунок 4e). Чтобы отслеживать динамические отношения между кластерами Т-клеток из опухоли NPC и периферической крови, мы количественно оценили экспансию (экспансия, клональная экспансия), миграция (мигр) и переход (транс, эволюционный переход или дифференцировка) Т-клеток, используя экспрессию генов и информацию о ТКР. методом STARTRAC 24 . Соответственно, мы наблюдали самую высокую подвижность перехода CD8_C11_PDCD1 с CD8_C10_MKI67, за которым следуют CD8_C7_GZMK, CD8_C8_MHC и CD8_C9_XCL1 (рис.2г). Эти наблюдения убедительно свидетельствуют о том, что клетки CD8_C11_PDCD1 в основном размножались за счет пролиферирующих предварительно истощенных внутриопухолевых Т-клеток CD8 + . Более того, мы наблюдали, что CD8_C5_CX3CR1 имел наибольшее количество клональных Т-клеток (дополнительный рис. 4d) и самую высокую подвижность экспансии в кластерах Т-клеток CD8 + (рис. 2е). Кроме того, CD8_C5_CX3CR1 имел самую высокую долю общих TCR между периферической кровью и опухолью (рис. 2e). Пропорции TCR, общих с периферическим CD8_C5_CX3CR1, варьировались от 4.От 76% до 12,77% для инфильтрации кластеров Т-клеток CD8 + (дополнительный рисунок 4e). Эти данные предполагают общее происхождение внутриопухолевых Т-клеток CD8 + в опухоли NPC от Т-клеток CD8 + в периферической крови, включая клетки CD8_C5_CX3CR1.
Разнообразие и траектория Treg-клеток в NPC
Treg-клетки являются мощными супрессорами иммунных клеток и необходимы для поддержания иммунологической толерантности и гомеостаза. Мы идентифицировали в общей сложности 11631 Treg-клетку на основе их транскрипции канонических маркеров ( CD4 , IL2RA и FOXP3 ), которые были сгруппированы в четыре кластера клеток, включая Treg_C1_SELL, Treg_C2_HSPA1A, Treg_C3_MKI674_ и Treg_C3_MKI674_ (.2a, дополнительный рисунок 5a, дополнительные данные 1 и 2). Мы наблюдали, что доля Treg-клеток среди CD4 + Т-клеток в опухолях была намного выше, чем доля в PBMC (дополнительный рис. 5b). Все клетки Treg_C4_TNFRSF4 и большинство клеток Treg_C2_HSPA1A (99,5%; 4762 из 4786) и Treg_C3_MKI67 (90,0%; 1187 из 1319) клеток были обнаружены в опухолях, тогда как клетки Treg_C1_SELL находились в PBMC (дополнительные данные 1). Чтобы изучить иммуно-регуляторные функции Treg-клеток, мы сначала рассчитали баллы IL2R для каждой клетки на основе уровня их экспрессии: CD25 (IL2RA), CD122 (IL2RB) и CD132 (IL2RG) с помощью AddModuleScore функция реализована в программном обеспечении Seurat.Три гена кодируют трансмембранные белки, которые образуют рецепторный комплекс, конкурентно связывающий IL2 (фактор роста Т-клеток) с высоким сродством, чтобы ингибировать эффекторные Т-клетки 25 . Мы наблюдали самый высокий балл IL2R для Treg_C4_TNFRSF4 среди всех кластеров Treg (рис. 3a), что указывает на самый сильный потенциал связывания IL-2 у клеток Treg_C4_TNFRSF4. Точно так же мы также наблюдали самые высокие показатели ингибирования и костимуляции для клеток Treg_C4_TNFRSF4 на основе уровней экспрессии ими генов с иммуно-ингибирующими функциями и костимулирующих рецепторов, соответственно (рис.3a и дополнительный рис. 5a), предполагая, что клетки Treg_C4_TNFRSF4 обладали более сильным подавляющим потенциалом иммунного ответа и были в большей степени активированы, чем другие клетки Treg. Соответственно, такая подгруппа Treg-клеток также была идентифицирована при CRC, NSCLC и гепатоцеллюлярной карциноме (HCC) с высоким потенциалом активации и иммуносупрессии, на что указывают высокие показатели IL2R, ингибирования и костимуляции (дополнительный рисунок 5c). ). Кроме того, мы наблюдали повышенные уровни экспрессии хемокиновых рецепторов в клетках Treg_C4_TNFRSF4, включая CXCR3, CXCR6 и CCR8 , которые были вовлечены в несколько видов рака 26 (дополнительный рис.5а).
Рис. 3: Профиль экспрессии и развитие Treg-клеток.a Графики скрипки показали IL2R (левая панель), ингибирующий (средняя панель) и костимулирующий (правая панель) баллы для каждого кластера Treg-клеток ( n = 11631). Коробчатые диаграммы внутри скрипок указывали квартили соответствующих уровней оценки. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1,5-кратный межквартильный размах; черные точки обозначают каждую ячейку.Графики скрипки окрашены в соответствии с типами клеток, а оценки подписи указаны по оси y . b Heatmap показала выбранные сигнальные пути (строки), которые были значительно обогащены анализами GO и KEGG для каждого кластера клеток Treg (столбцы). Цвета с заливкой от синего до красного представляют масштабированные уровни экспрессии (нормализованные значения –log 10 P ) от низкого до высокого. Значения P были рассчитаны с помощью одностороннего гипергеометрического теста и скорректированы для множественных сравнений.Оранжевые и фиолетовые квадраты в левом столбце представляют результаты, полученные в результате анализа сигнальных путей GO и KEGG, соответственно. c Анализ псевдовременной траектории Treg-клеток (Treg_C1, Treg_C2, Treg_C3 и Treg_C4; n = 11631) с генами с высокой вариабельностью. Каждая точка представляет одну отдельную ячейку, окрашенную в соответствии с ее меткой кластера. На входном графике каждая ячейка показывала псевдовременную оценку от темно-синего до желтого, что указывало на раннее и конечное состояния, соответственно. d Графики в виде прямоугольников показали оценки расширения (верхняя панель) и индекса миграции (нижняя панель) каждого кластера CD4 + Т-клеток ( n = 10). Сравнение проводилось с использованием двустороннего критерия Вилкоксона. Кластеры ячеек указаны на оси x , а ось y показывает индекс расширения или миграции на верхней или нижней панели соответственно. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1,5-кратный межквартильный размах; цветные точки обозначают каждого пациента. e Коробчатые диаграммы показали оценки индекса перехода Treg_C4_TNFRSF4 (левая панель) и Treg_C2_HSPA1A (правая панель) с другими клетками Treg ( n = 10). Сравнение проводилось с использованием двустороннего теста Краскела-Уоллиса. Кластеры ячеек и оценки индекса перехода указаны на осях x и y соответственно. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1,5-кратный межквартильный размах; цветные точки обозначают каждого пациента.
Чтобы охарактеризовать потенциальные функции клеток Treg, мы сначала выполнили анализ обогащения сигнального пути для каждого кластера Treg на основе уровней экспрессии генов, участвующих в каждом пути. Мы наблюдали отчетливую картину обогащения путей для каждого кластера Treg, предполагая их различные функции. В частности, «взаимодействие цитокин-цитокиновый рецептор» было сильно обогащено Treg_C4_TNFRSF4 (фиг. 3b), что согласуется с их хемотаксическими потенциалами, как упоминалось ранее.Более того, «продукция интерлейкина-10», «путь передачи сигналов TNF» и «путь передачи сигналов NF-κB» были обогащены как Treg_C4_TNFRSF4, так и Treg_C2_HSPA1A (фиг. 3b). Таким образом, мы дополнительно сравнили основные пути между Treg_C4_TNFRSF4 и Treg_C2_HSPA1A с использованием анализа обогащения набора генов (GSEA), который выявил более высокое обогащение путей, связанных с клеточным циклом, хемокинами, TGF-β, а также отрицательной регуляцией пролиферации Т-клеток. как факторы транскрипции, активирующие пути NF-κB и STAT в Treg_C4_TNFRSF4 (дополнительный рис.5г). Поскольку Treg_C4_TNFRSF4 специфически экспрессировал CCR8 (дополнительный рис. 5a), мы использовали нормализованное соотношение мРНК CCR8 / FOXP3 для оценки доли клеток Treg_C4_TNFRSF4 в клетках Treg ( FOXP3 + ). Анализ выживаемости показал, что более высокое соотношение CCR8 / FOXP3 было связано со снижением выживаемости без прогрессирования заболевания (PFS; дополнительный рис. 5e), предполагая, что более высокая фракция клеток Treg_C4_TNFRSF4 с активированным потенциалом в Treg-клетках имела сильный иммунный эффект. подавляющая функция у NPC.
Чтобы отследить происхождение внутриопухолевых Treg-клеток, мы сначала выполнили анализ псевдовременной траектории с использованием Monocle2, который выявил наиболее терминальный статус с наивысшими псевдовременными оценками для клеток Treg_C4_TNFRSF4 и две траектории развития Treg_C4_TNFRSF4 клеток из Treg_C4_C1_MC клеток Treg_C3_C1_MC опухоли (рис. 3в). Затем мы исследовали экспрессию тканевых резидентных маркеров ( CD69 , ITGAE и BHLHE40 ; дополнительная таблица 5) в клетках Treg и наблюдали гораздо более высокую экспрессию ITGAE и BHLHE40 в клетках Treg_C4_TNFRSF4 и Treg_C3_MKI_C3_MKI_C3_MKI_C3_MKI. и ячейки Treg_C1_SELL (дополнительный рис.6а). Учитывая, что большая часть клеток Treg_C2_HSPA1A находилась в опухолях и происходила из клеток Treg_C1_SELL в соответствии с анализом псевдовременной траектории (рис. 3c), скудная экспрессия резидентных маркеров может указывать на самый недавний набор клеток Treg_C2_HSPA1A из периферической крови.
Анализ репертуараTCR выявил 17 621 (из 47 384) CD4 + Т-лимфоцитов, отнесенных к клонотипам, среди которых Treg_C2_HSPA1A и Treg_C4_TNFRSF4 имели промежуточное количество клонотипов (дополнительный рис.6b и дополнительные данные 4). Примечательно, что Treg_C4_TNFRSF4 имел наибольшую долю клональных клеток, что означает наивысшую клональность среди всех Т-клеток CD4 + (дополнительный рис. 6b). Соответственно, мы наблюдали, что Treg_C4_TNFRSF4 имел наивысшую оценку экспансии, означающую самую высокую степень клональной экспансии среди кластеров Treg клеток (Fig. 3d). Мы также наблюдали самый высокий балл миграции, означающий самую высокую мобильность, для Treg_C1_SELL, происходящего из PBMC (Fig. 3d). Анализ DEG показал, что Treg_C1_SELL имеет высокую экспрессию хемокиновых рецепторов CCR4 , которые являются хемотаксическими аналогами для CCL5 , CCL17 и CCL22 , продуцируемых внутриопухолевыми CD8 + T, NK и миелоидными клетками в NPC (Supplementary Рис.5а и 6в). Эти наблюдения предполагают, что способность к миграции и потенциалы хемотаксического взаимодействия с внутриопухолевыми клетками делают возможным перемещение периферических клеток Treg_C1_SELL к месту опухоли. Действительно, мы наблюдали небольшое количество общих TCR между Treg-клетками из опухоли и периферической крови (дополнительный рис. 6d), что согласуется с предыдущим открытием, что внутриопухолевые Treg-клетки были частично рекрутированы из периферической крови 27 . Мы дополнительно исследовали мобильность перехода Treg_C2_HSPA1A и Treg_C4_TNFRSF4 с другими ячейками Treg.Мы заметили, что ячейки Treg_C4_TNFRSF4 имели самую высокую мобильность перехода с ячейками Treg_C3_MKI67, за которыми следовали ячейки Treg_C2_HSPA1A и Treg_C1_SELL; и ячейки Treg_C2_HSPA1A имели высокую мобильность перехода с ячейками Treg_C4_TNFRSF4 и Treg_C3_MKI67 (рис. 3e). Эти наблюдения снова подтвердили траекторию развития внутриопухолевых клеток Treg_C4_TNFRSF4 от наивных клеток Treg_C1_SELL через промежуточные клетки Treg_C2_HSPA1A или Treg_C3_MKI67 (Fig. 3c).
Разнообразие B-клеток в NPC
Мы идентифицировали в общей сложности 22 892 B-клетки, которые были сгруппированы в девять кластеров (дополнительный рис.7а, дополнительные данные 1 и 2). Среди них кластеры B_C1_TCL1A, B_C2_FCRL3 и Plamsa_C1_IgA были получены из PBMC, а другие шесть кластеров были взяты из образцов опухолей (дополнительный рис. 7a). Анализ DEG выявил уникальные генные сигнатуры для кластеров B-клеток в образцах опухолей, включая B_C5_ISG15 с генами, индуцированными интерфероном, B_C6_HSPA1A с стрессовой экспрессией генов и Plasma_C2_IgG с повышенным уровнем экспрессии генов IgH (дополнительный рис. 7b). Мы также идентифицировали два кластера B-клеток (B_C1_TCL1A и B_C4_IFITM3) перед рекомбинацией переключения классов на основе экспрессии IGHM и IGHD (дополнительный рис.7b и дополнительная таблица 5). Более того, корреляционный анализ показал, что экспрессия TCL1A сильно коррелировала с экспрессией IGHM и IGHD в двух кластерах, что могло быть достаточным маркером для классификации В-клеток до рекомбинации с переключением класса (дополнительный рисунок 7c). ). Анализ обогащения сигнального пути генов с дифференциальной экспрессией показал, что кластеры В-клеток были обогащены различными путями, связанными с иммунной регуляцией (дополнительный рис.7г). В частности, B_C4_IFITM3, B_C5_ISG15 и B_C6_HSPA1A имели обогащение «EBV-инфекцией», «защитным ответом на вирус», «вирусным канцерогенезом» и «ответом на пути интерферона-гамма», что позволяет предположить, что три группы клеток могут нести ответственность за иммунный ответ против EBV-инфекции (дополнительный рис. 7d).
Связанные с опухолью LAMP3
+ DC демонстрируют толерогенный фенотип в NPCВ общей сложности было идентифицировано 8 893 миелоидных клетки и сгруппировано в 10 подмножеств, включая одну для тучных клеток, пять для моноцитарных или макрофагальных клеток, три для обычных дендритных клеток и один для плазмоцитоидных дендритных клеток (рис.4a, дополнительные рисунки 8a и 8b, дополнительные данные 1 и 2). Среди четырех кластеров дендритных клеток DC_C2_CD1C, DC_C3_LAMP3 и DC_C4_JCHAIN были получены из опухолей, а DC_C1_FCER1A был получен из периферической крови, которая была отнесена к моноцитоподобным DC из-за экспрессии маркера моноцитов S100A8 (дополнительный рис. , б). Примечательно, что мы идентифицировали клетки DC_C3_LAMP3 как группу DC с высокими потенциалами созревания, активации и миграции в NPC на основе уровней экспрессии сигнатурных генов, связанных с созреванием ( LAMP3 , MARCKSL1 , IDO1, и UBD ), активация ( CD80 , CD83, и CD40 ) и миграция ( CCR7 , FSCN1 и SLCO5A1 ; рис.4b, дополнительный рисунок 8c и дополнительная таблица 5) соответственно. Более того, клетки DC_C3_LAMP3 имели высокую экспрессию специальных хемокиновых лигандов ( CCL17 , CCL19, и CCL22 ), которые, как известно, рекрутируют иммунные клетки, экспрессирующие хемокиновые рецепторы CCR4 , CCR7, и CXCR3 (фиг. . 4b). Мы также наблюдали значительную корреляцию экспрессии между маркером гена LAMP3 и другими функциональными генами, связанными с созреванием, миграцией, активацией и хемокиновыми лигандами в DC_C3_LAMP3 (дополнительный рис.8г). Эти наблюдения предполагают, что клетки DC_C3_LAMP3 могут быть LAMP3 + DCs, которые обладают высокой миграцией, активацией и созреванием при некоторых раках, как сообщалось ранее 28,29 .
Рис. 4: Экспрессия и развитие дендритных клеток.график UMAP для 8 893 миелоидных клеток, сгруппированных в 10 типов клеток. Каждая точка представляет собой ячейку, окрашенную в соответствии с типами ячеек. b Heatmap показала нормализованную среднюю экспрессию генов, связанных с созреванием, активацией, миграцией и хемокиновым лигандом (строки) в трех кластерах дендритных клеток (DC_C1, DC_C2 и DC_C3; столбцы).Закрашенные цвета от черного до желтого представляют масштабированные уровни экспрессии генов от низкого до высокого. c Heatmap показала выбранные пути передачи сигналов (строки) со значительным обогащением условий GO и KEGG для трех кластеров дендритных клеток (DC_C1, DC_C2 и DC_C3; столбцы). Цвета с заливкой от синего до красного представляют масштабированные уровни экспрессии (нормализованные значения –log 10 P ) от низкого до высокого. P -значения были рассчитаны с помощью одностороннего гипергеометрического теста и скорректированы для множественных сравнений.Оранжевые и фиолетовые квадраты в левом столбце представляют результаты, полученные в результате анализа сигнальных путей GO и KEGG, соответственно. d Графики скрипки показали дифференцировку, апоптоз, презентацию антигена и дисфункцию трех кластеров дендритных клеток (DC_C1, DC_C2 и DC_C3; n = 1134). Коробчатые диаграммы внутри скрипок указывали квартили соответствующих уровней оценки. Конечные точки отображают минимальные и максимальные значения; центральные линии обозначают медианные значения; усы обозначают 1.5 × межквартильный размах; черные точки обозначают каждую ячейку. Кластеры ячеек и оценки подписи указаны на осях x и y соответственно. e Анализ псевдовременной траектории трех кластеров дендритных клеток (DC_C1, DC_C2 и DC_C3; n = 1134) с генами с высокой вариабельностью. Каждая точка представляет одну отдельную ячейку, окрашенную в соответствии с ее меткой кластера. На входном графике каждая ячейка показывала псевдовременную оценку от темно-синего до желтого, что указывало на раннее и конечное состояния, соответственно.Диаграмма f Венна показывает перекрывающиеся факторы транскрипции, регулирующие ген LAMP3, , иммуносупрессивные молекулы и HLA-II в клетках DC_C3_LAMP3.
Анализ обогащения сигнального пути с использованием GO и KEGG выявил специфический паттерн обогащенных путей среди трех обычных кластеров клеток DC, где «процессинг и презентация антигена» был значительно повышен в DC_C2_CD1C, но подавлен в DC_C3_LAMP3 (рис. 4c). Более того, сигнальные пути апоптоза, NF-κB и MAPK, а также дифференцировка миелоидных клеток также были активированы в DC_C3_LAMP3 по сравнению с двумя другими кластерами (рис.4в). Эти наблюдения согласуются с анализом GSEA (дополнительный рис. 8e). Таким образом, мы оценили уровни экспрессии генов, связанных с этими путями, в каждом кластере (дополнительные данные 3), которые выявили самые высокие уровни дифференцировки и апоптоза, но самую низкую презентацию антигена для DC_C3_LAMP3 (фиг. 4d). Кроме того, мы наблюдали, что сигнатуры генов, соответствующие активации иммунного ответа, были снижены в DC_C3_LAMP3 (рис. 4c), что согласуется с наивысшим иммунно-регуляторным баллом и повышенной экспрессией подмножества иммуносупрессивных генов, включая CD274 (PD-L1), PDCD1LG2 (PD-L2), CD200 , EBI3 , IDO1 , IL4I1 , SOCS1 , SOCS2 и SOCS3 (дополнительный рис.9а и дополнительные данные 3). Кроме того, мы наблюдали аналогичный профиль экспрессии LAMP3 + DC среди NPC, HCC и NSCLC (дополнительный рис. 9a). Эти наблюдения предполагают, что клетки DC_C3_LAMP3 можно рассматривать как группу регуляторных и толерогенных DC, которые сдерживают активацию Т-клеток 30 .
Затем мы выполнили анализ псевдовременной траектории и наблюдали, что клетки DC_C1_FCER1A развились в две ветви, включая клетки DC_C2_CD1C и DC_C3_LAMP3, и клетки DC_C3_LAMP3 имели наивысший псевдовременный балл, означающий наиболее дифференцированный и созревший DC (рис.4д). В сочетании с их иммунорегуляторными и антигенпредставляющими баллами (рис. 4d) эти данные предполагают, что клетки DC_C1_FCER1A в периферической крови могут проникать в опухоль, конвертироваться в клетки DC_C2_CD1C с повышенной антигенпредставляющей способностью и в иммуносупрессивные клетки DC_C3_LAMP3 (рис. . 4e). Соответственно, мы наблюдали аналогичный паттерн изменений в экспрессии факторов транскрипции (TF), специфичных для генов с дифференциальной экспрессией от DC_C1_FCER1A до DC_C2_CD1C, а затем в клетках DC_C3_LAMP3 (дополнительный рис.9б). Мы также построили точную клеточную сеть, чтобы сделать вывод о регулонах, связанных с факторами транскрипции и сигнальными молекулами в DC_C3_LAMP3, используя ARACNe (дополнительные данные 5). Мы наблюдали, что повышенная регуляция LAMP3 была связана с несколькими TF, включая ETV3 , ETV6 , HMGN3 , GPBP1 , TRAFD1 , ATF3 , KDM2B , JUN , HIV , KLF6 , ZBTB10 и NFKB1 , которые были связаны с созреванием DC у мыши 31 , в то время как подавление активности LAMP3 было связано с CREM (дополнительный рис.9в). Мы также заметили, что среди этих TF KDM2B , KLF6 , ETV6 , JUN , HMGN3 и TRAFD1 , а также NFKB1 , REL, и RELB в NF. -κB были связаны с повышенной экспрессией иммуносупрессивных молекул, таких как CD274 , PDCD1LG2 , CD200 и IDO1 , но с подавлением экспрессии генов HLA-класса II (рис. 4f и дополнительный рис.9в). Напротив, SOX4 и CREM были связаны с подавлением CD274 , CD200 и IDO1 (дополнительный рис. 9c). Эти наблюдения предполагают, что множественные TF регулируют иммуносупрессивную функцию, антигенпрезентирующую способность и созревание DC_C3_LAMP3 в NPC.
Неоднородность злокачественных клеток с различным статусом инфицирования EBV
Мы идентифицировали в общей сложности 2787 злокачественных эпителиальных клеток в опухолях NPC на основании наличия в них крупномасштабных вариаций числа хромосомных копий (CNV) по сравнению со справочными данными нормальных эпителиальных клеток 32 (см. Методы; рис.5а). Учитывая, что EBV является известным фактором, ответственным за злокачественную трансформацию и туморогенез NPC 33 , мы исследовали экспрессию молекул EBV в злокачественных клетках и разделили их на EBV + (EP_C1_LMP1) и EBV — (EP_C2_EPCAM). злокачественные клетки в соответствии с их детектируемыми или не обнаруживаемыми транскриптами EBV ( LMP-1 / BNLF2a / b, RPMS1 / A73, LMP-2A / B и BNRF1 ; рис. 5b, c, дополнительный рисунок 10a, дополнительные данные 1 и 2). Мы наблюдали более высокую экспрессию EPHA2 и EGFR в клетках EP_C1_LMP1 (рис.5d), которые были связаны с восприимчивостью к EBV-инфекции 34 . Более того, иммунофлуоресцентное окрашивание белка, кодируемого EBV (LMP1), подтвердило присутствие злокачественных клеток EBV + (LMP1 + EPCAM + ) и злокачественных клеток EBV — (LMP1 — EPCAM + ). в NPC (рис. 5д). Мы также наблюдали особенно высокую активацию основных генов, участвующих в путях NF-κB и Notch, а также хемокинов, включая CX3CL1 в EP_C1_LMP1 по сравнению с клетками EP_C2_EPCAM (рис.5г). Соответственно, мы наблюдали высокую экспрессию CX3CL1 в независимой коллекции опухолей NPC ( n = 113) по сравнению с доброкачественными образцами (ринит, n = 10; дополнительный рис. 10b). Интересно, что мы отметили сверхэкспрессию CX3CR1 , рецептора CX3CL1 , во множестве типов иммунных клеток в периферической крови (дополнительный рис. 10c). Анализ обогащения сигнального пути показал, что EP_C1_LMP1 обогащен цитокин-опосредованными, регулирующими гибель клеток, апоптозом и связанными с раком путями (рис.5е). Взятые вместе, эти наблюдения предполагают, что злокачественные клетки NPC проявляют различную восприимчивость к инфекции EBV, что приводит к различным профилям экспрессии.
Рис. 5: Гетерогенность злокачественных клеток с отчетливой EBV-инфекцией в опухолевых тканях.a Heatmap показала крупномасштабные CNV для эпителиальных клеток (ряды по оси y ) из 10 опухолей NPC. CNVs были выведены в соответствии со средней экспрессией 100 генов, охватывающих каждую хромосомную позицию ( x -ось).Красный: выигрыш; синий: потери. Злокачественные клетки NPC от разных пациентов и ряд различных хромосом обозначены разными цветными полосами слева и вверху на тепловой карте, соответственно. b График UMAP из 2787 злокачественных клеток, сгруппированных в два кластера клеток (EP_C1_LAMP1 и EP_C2_EPCAM). Каждая точка представляет собой ячейку, окрашенную в соответствии с кластером ячеек. c Графики UMAP показали экспрессию кодируемых EBV генов ( LMP-1 / BNLF2a / b , RPMS1 / A73 , LMP-2A / B, и BNRF1 ) в злокачественных клетках.Каждая точка представляет собой отдельную ячейку, а глубина цвета от серого до красного соответствует выражению от низкого до высокого. d Графики скрипки показали нормализованную экспрессию кластерных маркеров, хемокинов и генов, связанных с путями NF-κB и Notch в каждом кластере. На каждом графике кластеры клеток и уровень экспрессии гена в виде плитки диаграммы указаны на осях x и y соответственно. e Типичные изображения множественного иммунофлуоресцентного окрашивания злокачественных клеток в тканях NPC.Белки, обнаруженные с помощью соответствующих антител в анализах, указаны вверху. Красные, зеленые и оранжевые стрелки указывают типичные клетки, положительные по EPCAM, LMP1 и коэкспрессии белков EPCAM и LMP1 в злокачественных клетках, соответственно. Изображения представляют три биологических повтора. Масштабные линейки 50 мкм. f Столбчатые диаграммы показали выбранные сигнальные пути со значительным обогащением терминов GO (верхняя панель) и KEGG (нижняя панель) для злокачественных клеток EBV + (EP_C1_LMP1) по сравнению со злокачественными клетками EBV — (EP_C2_EPCAM), окрашенными от от светлого к темному в соответствии с их −log 10 (значения P- ) от низкого к высокому.Значения P- были рассчитаны с помощью одностороннего гипергеометрического теста и скорректированы для множественных сравнений.
Для дальнейшего изучения внутриопухолевой и межопухолевой гетерогенности злокачественных клеток NPC мы сначала разделили их на пять основных клеточных подгрупп (C1 – C5; дополнительный рис. 10d, e), используя кластерный анализ без информации о EBV. Затем мы расшифровали вариации экспрессии генов в злокачественных клетках для разных кластеров с помощью анализа вариаций набора генов (GSVA), который выявил явное обогащение сигнального пути для каждого кластера (дополнительный рис.10f). Мы наблюдали различные пропорции подтипов клеток среди различных образцов опухолей (дополнительный рис. 10e), которые могут вносить вклад в профили гетерогенной экспрессии между опухолями. Действительно, данные GSVA показали различное обогащение сигнальных путей среди образцов опухолей (дополнительный рис. 10f). Примечательно, что образцы P02, P08, P11 и P15 с более высокой долей кластера C4 по сравнению с другими образцами показали обогащение путей, связанных с клеточным циклом (E2F, MYC и G2M checkpoint) (дополнительный рис.10e – g), хотя кластер C4 имел самые высокие показатели пролиферации, но в целом низкое содержание в опухолях NPC по сравнению с тремя другими кластерами. Эти наблюдения предполагают внутри- и межопухолевую гетерогенность злокачественных клеток в NPC.
Сеть межклеточного взаимодействия в NPC
Чтобы исследовать сеть сотовой связи в NPC, мы исследовали возможное связывание лиганд-рецептор между различными кластерами клеток, происходящими из опухолей NPC и PBMC, с использованием программного обеспечения CellPhoneDB 35 (дополнительные данные 6).Мы наблюдали интенсивные клеточные взаимодействия между клетками DC_C3_LAMP3, Treg-клетками и истощенными CD8 + Т-клетками (CD8_C11_PDCD1) через ингибирующие, костимулирующие молекулы или хемокины (рис. 6a, b). Среди них было предсказано, что клетки DC_C3_LAMP3 взаимодействуют с клетками Treg_C1_SELL в периферической крови через CCL17-CCR4 и CCL22-CCR4, которые, как известно, рекрутируют клетки Treg в опухолевую ткань 36 (фиг. 6a). Клетки Treg_C4_TNFRSF4 имели высокую экспрессию CTLA4, ENTPD1 и CSF1, что показало связывание лиганд-рецептор с CD80 / CD86, ADORA2A и SIRPA на клетках DC_C3_LAMP3, что свидетельствует о потенциальном взаимодействии между клетками Treg_C4_TNFRSF4 и DC3_C3_C3_C3.6а). Также было предсказано, что клетки DC_C3_LAMP3 взаимодействуют с клетками CD8_C11_PDCD1 посредством передачи сигналов CD200-CD200R, неклассического иммуносупрессивного пути, участвующего в подавлении противоопухолевых ответов 37 (фиг. 6b). Потенциальные взаимодействия лиганд-рецептор наблюдались между клетками Treg_C4_TNFRSF4 и CD8_C11_PDCD1, включая таковые хемокинов (CCL4-CCR8), адгезивного соединения (ITGAL-ICAM1 и SELPLG-SELL) и иммунной регуляции (HAVCR2-LGALS9; рис. 6b и дополнительные данные) ), которые хорошо известны в TME опухолей и способствуют иммуносупрессивной активности Treg-клеток и истощения Т-клеток CD8 + 26,38 .Примечательно, что эти потенциальные взаимодействия обычно наблюдались в нашей когорте NPC (дополнительный рис. 11a). Соответственно, в другой независимой коллекции образцов NPC ( n = 113) мы наблюдали сильную корреляцию экспрессии между сигнатурами генов для клеток DC_C3_LAMP3, Treg-клеток и истощенных CD8 + Т-клеток (CD8_C11_PDCD1; r > 0,8, P <2,2 × 10 −16 ; дополнительный рис. 11б). Эти наблюдения предполагают широкое распространение иммуно-регуляторных взаимодействий между клетками DC_C3_LAMP3, Treg_C4_TNFRSF4 и CD8_C11_PDCD1 в опухолях NPC.Мы также выполнили множественное иммуногистохимическое (ИГХ) окрашивание биоптатов NPC и подтвердили физическое сопоставление CD80-экспрессирующих клеток DC_C3_LAMP3 (CD80 + ) и CTLA4-экспрессирующих Treg-клеток (CD3 + CD4 + FOXP3 + ). а также PD-L1-экспрессирующие клетки DC_C3_LAMP3 (CD80 + ) и PD-1-экспрессирующие CD8 + Т-клетки (CD3 + CD8 + ; фиг. 6c, d).
Рис. 6: Межклеточные взаимодействия между иммунными и злокачественными клетками в NPC.a , b На точечных графиках показаны выбранные взаимодействия лиганд-рецептор между двумя кластерами клеток, для клеток Treg и DC_C3_LAMP3 ( a ) и для истощенных клеток CD8 + T (CD8_C11_PDCD1) и клеток DC_C3_LAMP3 (9000_LAMP3) ). Взаимодействия лиганд-рецептор и межклеточные взаимодействия указаны в столбцах и строках соответственно. Средние значения средних уровней экспрессии двух взаимодействующих молекул указаны на цветной тепловой карте (правая панель), где от синего до красного соответствует экспрессия от низкой до высокой.Журнал 10 (значения P- ) был обозначен размером круга в одностороннем перестановочном тесте. Разные цветные прямоугольники внизу представляют разные функциональные модули взаимодействий рецептор-лиганд. c Репрезентативные изображения множественного окрашивания ИГХ для сопоставления CTLA4-экспрессирующих клеток Treg (CD3 + CD4 + FOXP3 + ) и CD80-экспрессирующих клеток DC_C3_LAMP3 в образцах тканей NPC. Белки, обнаруженные с помощью соответствующих антител, указаны вверху.Зеленая, красная, пурпурная, голубая и оранжевая стрелки указывают положительные клетки с экспрессией белков CD3, CD4, FOXP3, CTLA4 и CD80 в ткани NPC, соответственно (нижняя панель). Изображения представляют три биологических повтора. Масштабные линейки, 100 мкм и 20 мкм для верхней и нижней панелей соответственно. d Типичные изображения множественного окрашивания ИГХ для сопоставления PD1-экспрессирующих CD8 + Т-клеток (CD3 + CD8 + ) и PD-L1-экспрессирующих клеток DC_C3_LAMP3 (CD80 + ) в образцах тканей NPC .Белки, обнаруженные с помощью соответствующих антител, указаны вверху. Желтая, голубая, пурпурная, красная и зеленая стрелки указывают на положительные клетки с экспрессией белков CD3, CD8, CD80, PD1 и PD-L1 в ткани NPC, соответственно (нижняя панель). Изображения представляют три биологических повтора. Масштабные линейки 100 и 20 мкм для верхней и нижней панелей соответственно.
Между злокачественными клетками NPC и иммунными клетками мы наблюдали, что клетки EBV + EP_C1_LMP1 имели значительно больше взаимодействий рецептор-лиганд, чем клетки EBV — EP_C2_EPCAM у каждого пациента с NPC (дополнительный рис.12а). Мы отметили, что клетки EP_C1_LMP1 однозначно экспрессируют CX3CL1 в опухоли, что, как было предсказано, взаимодействует с CX3CR1, экспрессируемым на периферических иммунных клетках, включая клетки CD8_C5_CX3CR1, клетки DC_C1_FCER1A, NK-клетки и моноциты (дополнительный рис. 12b), что свидетельствует о хемотаксическом потенциале EP_C1_L клеток EP_C1_L. иммунные клетки периферической крови. Более того, мы наблюдали, что EGFR на клетках EP_C1_LMP1, как предполагается, связывает TGFB1 на множестве типов клеток, что, как сообщается, регулирует жизненный цикл EBV 39 (дополнительный рис.12в). Мы также наблюдали потенциальные взаимодействующие пары между клетками EP_C1_LMP1 с активированным путем Notch и несколькими типами клеток через NOTCh2-TNF и NOTCh3-JAG2, которые были связаны с радиационной чувствительностью 40 и раковыми стволовыми побочными популяционными клетками 41 в NPC ( Дополнительный рис. 12d). Кроме того, вышеупомянутые взаимодействия обычно определялись, но с индивидуальной переменной интенсивностью среди пациентов (дополнительные данные 6), что позволяет предположить, что взаимодействия являются широко распространенным явлением и неоднородны в NPC (дополнительный рис.12б – г).
Межклеточная коммуникация, опосредованная внеклеточными везикулами: роль в микросреде опухоли и устойчивость к противораковым лекарствам | Молекулярный рак
Наито Ю., Йошиока Ю., Ямамото Ю., Очия Т. Как раковые клетки определяют свое микроокружение: настоящая роль внеклеточных везикул. Cell Mol Life Sci. 2017; 74 (4): 697–713.
CAS Статья Google Scholar
Салливан Р., Мареш Дж., Чжан Х, Саломон С., Хупер Дж., Марголин Д. и др.Новые роли внеклеточных везикул как средств коммуникации в микросреде опухоли и за ее пределами. Фронт-эндокринол (Лозанна). 2017; 8: 194.
Артикул Google Scholar
Liu Y, Cao X. Происхождение и функция опухолевых макрофагов. Cell Mol Immunol. 2015; 12 (1): 1–4.
PubMed Статья CAS PubMed Central Google Scholar
Xing F, Saidou J, Watabe K. Связанные с раком фибробласты (CAF) в микроокружении опухоли. Front Biosci (Landmark Ed). 2010; 15: 166–79.
CAS Статья Google Scholar
ван Нил Дж., Д’Анджело Дж., Рапозо Дж. Изучение клеточной биологии внеклеточных везикул. Nat Rev Mol Cell Biol. 2018; 19 (4): 213–28.
PubMed Статья CAS PubMed Central Google Scholar
Nabhan JF, Hu RX, Oh RS, Cohen SN, Lu Q. Формирование и высвобождение микровезикул, опосредованных белком 1, опосредованных аррестиновым доменом (ARMM), на плазматической мембране путем привлечения белка TSG101. P Natl Acad Sci USA. 2012. 109 (11): 4146–51.
CAS Статья Google Scholar
Минчакки В.Р., Фриман М.Р., Ди Визио Д. Внеклеточные везикулы при раке: экзосомы, микровезикулы и новая роль крупных онкосом. Semin Cell Dev Biol.2015; 40: 41–51.
CAS PubMed PubMed Central Статья Google Scholar
Maas SLN, Breakefield XO, Weaver AM. Внеклеточные везикулы: уникальные межклеточные средства доставки. Trends Cell Biol. 2017; 27 (3): 172–88.
CAS PubMed Статья PubMed Central Google Scholar
Abels ER, Breakefield XO. Введение во внеклеточные везикулы: биогенез, выбор груза РНК, содержание, высвобождение и захват.Cell Mol Neurobiol. 2016; 36 (3): 301–12.
CAS PubMed PubMed Central Статья Google Scholar
Трайкович К., Хсу С., Кьянтия С., Раджендран Л., Венцель Д., Виланд Ф. и др. Керамид запускает почкование везикул экзосом в мультивезикулярные эндосомы. Наука. 2008. 319 (5867): 1244–7.
CAS PubMed Статья Google Scholar
Косака Н., Игучи Х., Йошиока Й., Такешита Ф., Мацуки Й., Очия Т.Секреторные механизмы и межклеточный перенос микроРНК в живых клетках. J Biol Chem. 2010. 285 (23): 17442–52.
CAS PubMed PubMed Central Статья Google Scholar
van Niel G, Charrin S, Simoes S, Romao M, Rochin L, Saftig P, et al. Тетраспанин CD63 регулирует ESCRT-независимую и зависимую от эндосом сортировку во время меланогенеза. Dev Cell. 2011. 21 (4): 708–21.
PubMed PubMed Central Статья CAS Google Scholar
Savina A, Fader CM, Damiani MT, Colombo MI. Rab11 способствует стыковке и слиянию мультивезикулярных телец кальций-зависимым образом. Движение. 2005. 6 (2): 131–43.
CAS PubMed PubMed Central Статья Google Scholar
Хсу С., Морохаши Ю., Йошимура С., Манрике-Ойос Н., Юнг С., Лаутербах М.А. и др. Регулирование секреции экзосом с помощью Rab35 и его белков, активирующих ГТФазу, TBC1D10A-C. J Cell Biol. 2010. 189 (2): 223–32.
CAS PubMed PubMed Central Статья Google Scholar
Хосино Д., Киркбрайд К.С., Костелло К., Кларк Э.С., Синха С., Грега-Ларсон Н. и др. Секреция экзосом усиливается инвадоподиями и приводит к инвазивному поведению. Cell Rep., 2013; 5 (5): 1159–68.
CAS Статья Google Scholar
Ostrowski M, Carmo NB, Krumeich S, Fanget I., Raposo G, Savina A, et al.Rab27a и Rab27b контролируют разные этапы пути секреции экзосом. Nat Cell Biol. 2010; 12 (1): 19–30, стр. 1–13.
CAS PubMed PubMed Central Статья Google Scholar
Bobrie A, Krumeich S, Reyal F, Recchi C, Moita LF, Seabra MC, et al. Rab27a поддерживает экзосомозависимые и независимые механизмы, которые модифицируют микроокружение опухоли и могут способствовать прогрессированию опухоли. Cancer Res. 2012. 72 (19): 4920–30.
CAS Статья Google Scholar
Sinha S, Hoshino D, Hong NH, Kirkbride KC, Grega-Larson NE, Seiki M, et al. Кортактин способствует секреции экзосом, контролируя динамику разветвленного актина. J Cell Biol. 2016; 214 (2): 197–213.
CAS PubMed PubMed Central Статья Google Scholar
Muralidharan-Chari V, Clancy J, Plou C, Romao M, Chavrier P, Raposo G, et al.ARF6-регулируемое отторжение микровезикул плазматической мембраны, происходящих из опухолевых клеток. Curr Biol. 2009. 19 (22): 1875–85.
CAS PubMed PubMed Central Статья Google Scholar
Wang Q, Lu Q. Внеклеточные микровезикулы, происходящие из плазматической мембраны, опосредуют неканоническую межклеточную передачу сигналов NOTCH. Nat Commun. 2017; 8 (1): 709.
PubMed PubMed Central Статья CAS Google Scholar
Raposo G, Stoorvogel W. Внеклеточные везикулы: экзосомы, микровезикулы и другие. J Cell Biol. 2013; 200 (4): 373–83.
CAS PubMed PubMed Central Статья Google Scholar
Mulcahy LA, Pink RC, Carter DR. Пути и механизмы захвата внеклеточных везикул. J Внеклеточные везикулы. 2014; 3.
Zhang L, Zhao Y, Dai Y, Cheng JN, Gong Z, Feng Y, et al. Иммунный ландшафт микросреды опухоли колоректального рака из разных локализаций первичной опухоли.Фронт Иммунол. 2018; 9: 1578.
PubMed PubMed Central Статья CAS Google Scholar
Quail DF, Joyce JA. Регуляция развития опухоли и метастазирования в микросреде. Nat Med. 2013. 19 (11): 1423–37.
CAS PubMed PubMed Central Статья Google Scholar
Бебельман М.П., Смит М.Дж., Пегтель Д.М., Баглио С.Р. Биогенез и функция внеклеточных везикул при раке.Pharmacol Ther. 2018; 188: 1–11.
CAS PubMed Статья Google Scholar
Товар-Камарго О.А., Тоден С., Гоэль А. Биомаркеры экзосомальной микроРНК: новые границы в колоректальном и других раках человека. Эксперт Rev Mol Diagn. 2016; 16 (5): 553–67.
CAS PubMed PubMed Central Статья Google Scholar
Хиггинботэм Дж., Демори Беклер М., Гепхарт Дж. Д., Франклин Дж. Л., Богачева Г., Кремерс Г. Дж. И др.Экзосомы амфирегулина увеличивают инвазию раковых клеток. Curr Biol. 2011. 21 (9): 779–86.
CAS PubMed PubMed Central Статья Google Scholar
Рак Дж, Гуха А. Внеклеточные везикулы — носители, распространяющие гены рака. Биологические исследования. 2012. 34 (6): 489–97.
CAS PubMed Статья Google Scholar
Шига К., Хара М., Нагасаки Т., Сато Т., Такахаши Х., Такеяма Х.Связанные с раком фибробласты: их характеристики и их роль в росте опухолей. Раки (Базель). 2015; 7: 2443–58.
Артикул Google Scholar
Гуо В., Гао И, Ли Н, Шао Ф, Ван С., Ван П и др. Экзосомы: новые игроки в борьбе с раком (обзор). Онкол Реп. 2017; 38 (2): 665–75.
PubMed PubMed Central Статья CAS Google Scholar
Фу Х, Ян Х, Чжан Х, Сюй В.Новые роли экзосом во взаимодействии опухоль-строма. J Cancer Res Clin Oncol. 2016; 142 (9): 1897–907.
CAS PubMed Статья PubMed Central Google Scholar
Антоняк М.А., Ли Б., Бороуз Л.К., Джонсон Д.Л., Друсо Дж.Э., Брайант К.Л. и др. Микровезикулы, происходящие из раковых клеток, вызывают трансформацию путем переноса тканевой трансглутаминазы и фибронектина в клетки-реципиенты. Proc Natl Acad Sci U S. A. 2011; 108 (12): 4852–7.
CAS PubMed PubMed Central Статья Google Scholar
Джусти И., Ди Франческо М., Д’Аскенцо С., Пальмерини М.Г., Маккиарелли Дж., Карта Дж. И др. Внеклеточные везикулы, происходящие из рака яичников, влияют на нормальное поведение фибробластов человека. Cancer Biol Ther. 2018; 19 (8): 722–34.
CAS PubMed PubMed Central Google Scholar
Webber JP, Spary LK, Sanders AJ, Chowdhury R, Jiang WG, Steadman R, et al.Дифференциация опухолевых стромальных миофибробластов по экзосомам рака. Онкоген. 2015; 34 (3): 290–302.
CAS PubMed Статья PubMed Central Google Scholar
Baglio SR, Lagerweij T, Perez-Lanzon M, Ho XD, Leveille N, Melo SA и др. Блокирование паракринной активности МСК, образованной опухолью, останавливает прогрессирование остеосаркомы. Clin Cancer Res. 2017; 23 (14): 3721–33.
CAS PubMed Статья PubMed Central Google Scholar
Cho JA, Park H, Lim EH, Lee KW. Экзосомы из клеток рака груди могут превращать мезенхимальные стволовые клетки жировой ткани в миофибробластоподобные клетки. Int J Oncol. 2012; 40 (1): 130–8.
CAS PubMed PubMed Central Google Scholar
Луджини Л., Валтьери М., Федеричи С., Чеккетти С., Мешини С., Конделло М. и др. Экзосомы колоректального рака человека вызывают опухолевидное поведение мезенхимальных стромальных клеток толстой кишки.Oncotarget. 2016; 7 (31): 50086–98.
PubMed PubMed Central Статья Google Scholar
Барони С., Ромеро-Кордова С., Плантамура I, Дуго М., Д’Ипполито Е., Катальдо А. и др. Опосредованная экзосомами доставка miR-9 индуцирует связанные с раком фибробластоподобные свойства в фибробластах молочной железы человека. Cell Death Dis. 2016; 7 (7): e2312.
CAS PubMed PubMed Central Статья Google Scholar
Ричардс К.Э., Зеленяк А.Е., Фишел М.Л., Ву Дж., Литтлпейдж Л.Э., Хилл Р. Экзосомы фибробластов, ассоциированные с раком, регулируют выживание и пролиферацию раковых клеток поджелудочной железы. Онкоген. 2017; 36 (13): 1770–8.
CAS PubMed PubMed Central Статья Google Scholar
Луга В., Чжан Л., Вилория-Пети А.М., Огунджими А.А., Инанлоу М.Р., Чиу Э. и др. Экзосомы опосредуют стромальную мобилизацию аутокринной передачи сигналов Wnt-PCP при миграции клеток рака молочной железы.Клетка. 2012. 151 (7): 1542–56.
CAS PubMed Статья PubMed Central Google Scholar
Donnarumma E, Fiore D, Nappa M, Roscigno G, Adamo A, Iaboni M и др. Связанные с раком фибробласты выделяют экзосомальные микроРНК, которые определяют агрессивный фенотип рака груди. Oncotarget. 2017; 8 (12): 19592–608.
PubMed PubMed Central Статья Google Scholar
Тодорова Д., Симончини С., Лакруа Р., Сабатье Ф., Дигнат-Джордж Ф. Внеклеточные везикулы в ангиогенезе. Circ Res. 2017; 120 (10): 1658–73.
CAS PubMed PubMed Central Статья Google Scholar
Аль-Недави К., Михан Б., Кербел Р.С., Эллисон А.С., Рак Дж. Эндотелиальная экспрессия аутокринного VEGF при захвате микровезикул опухолевого происхождения, содержащих онкогенный EGFR. Proc Natl Acad Sci U S. A. 2009; 106 (10): 3794–9.
PubMed PubMed Central Статья Google Scholar
Thompson CA, Purushothaman A, Ramani VC, Vlodavsky I, Sanderson RD. Гепараназа регулирует секрецию, состав и функцию экзосом, происходящих из опухолевых клеток. J Biol Chem. 2013. 288 (14): 10093–9.
CAS PubMed PubMed Central Статья Google Scholar
Свенссон К.Дж., Кухаржевска П., Кристиансон Х.С., Скольд С., Лофстедт Т., Йоханссон М.С. и др.Гипоксия запускает проангиогенный путь с участием микровезикул раковых клеток и PAR-2-опосредованную гепарин-связывающую передачу сигналов EGF в эндотелиальных клетках. Proc Natl Acad Sci U S. A. 2011; 108 (32): 13147–52.
CAS PubMed PubMed Central Статья Google Scholar
Кухаржевска П., Кристиансон Х.С., Велч Дж. Э., Свенссон К. Дж., Фредлунд Э., Рингнер М. и др. Экзосомы отражают гипоксический статус клеток глиомы и опосредуют зависимую от гипоксии активацию сосудистых клеток во время развития опухоли.Proc Natl Acad Sci U S. A. 2013; 110 (18): 7312–7.
CAS PubMed PubMed Central Статья Google Scholar
Huang Z, Feng Y. Экзосомы, полученные из гипоксических клеток колоректального рака, способствуют ангиогенезу посредством индуцированной Wnt4 передачи сигналов бета-катенина в эндотелиальных клетках. Oncol Res. 2017; 25 (5): 651–61.
PubMed Статья PubMed Central Google Scholar
Чжуан Г., Ву Х, Цзян З, Касман И., Яо Дж, Гуань И и др. MiR-9, секретируемая опухолью, способствует миграции эндотелиальных клеток и ангиогенезу за счет активации пути JAK-STAT. EMBO J. 2012; 31 (17): 3513–23.
CAS PubMed PubMed Central Статья Google Scholar
Шрути Т.В., Эдатт Л., Раджи Г.Р., Кунхираман Х., Шанкар С.С., Шанкар В. и др. Горизонтальный перенос miR-23a из колоний гипоксических опухолевых клеток может индуцировать ангиогенез.J. Cell Physiol. 2018; 233 (4): 3498–514.
CAS PubMed Статья PubMed Central Google Scholar
Kosaka N, Iguchi H, Hagiwara K, Yoshioka Y, Takeshita F, Ochiya T. Зависимый от нейтральной сфингомиелиназы 2 (nSMase2) экзосомальный перенос ангиогенных микроРНК регулирует метастазирование раковых клеток. J Biol Chem. 2013. 288 (15): 10849–59.
CAS PubMed PubMed Central Статья Google Scholar
Tauriello DVF, Batlle E. Нацеленность на микросреду при распространенном колоректальном раке. Тенденции рака. 2016; 2 (9): 495–504.
PubMed Статья PubMed Central Google Scholar
Wieckowski EU, Visus C, Szajnik M, Szczepanski MJ, Storkus WJ, Whiteside TL. Микровезикулы, происходящие из опухоли, способствуют росту регуляторных Т-клеток и индуцируют апоптоз в опухолево-реактивных активированных CD8 + Т-лимфоцитах. J Immunol. 2009. 183 (6): 3720–30.
CAS PubMed PubMed Central Статья Google Scholar
Андреола Г., Риволтини Л., Кастелли С., Хубер В., Перего П., Дехо П. и др. Индукция апоптоза лимфоцитов за счет секреции опухолевых клеток микровезикул, несущих FasL. J Exp Med. 2002. 195 (10): 1303–16.
CAS PubMed PubMed Central Статья Google Scholar
Abusamra AJ, Zhong Z, Zheng X, Li M, Ichim TE, Chin JL, et al.Экзосомы опухоли, экспрессирующие лиганд Fas, опосредуют апоптоз CD8 + Т-клеток. Blood Cells Mol Dis. 2005. 35 (2): 169–73.
CAS Статья Google Scholar
Ким Дж. У., Вецковски Э., Тейлор Д. Д., Райхерт Т. Е., Уоткинс С., Уайтсайд, TL. Положительные по Fas-лиганду мембранные везикулы, выделенные из сыворотки пациентов с раком полости рта, вызывают апоптоз активированных Т-лимфоцитов. Clin Cancer Res. 2005. 11 (3): 1010–20.
CAS PubMed PubMed Central Google Scholar
Huber V, Fais S, Iero M, Lugini L, Canese P, Squarcina P и др. Клетки колоректального рака человека вызывают гибель Т-клеток за счет высвобождения проапоптотических микровезикул: роль в ускользании от иммунитета. Гастроэнтерология. 2005. 128 (7): 1796–804.
CAS PubMed Статья PubMed Central Google Scholar
Клиби Дж., Ники Т., Ридель А., Пиош-Дюрье С., Сукер С., Рубинштейн Е. и др. Диффузия крови и Th2-супрессивные эффекты экзосом, содержащих галектин-9, высвобождаемых инфицированными вирусом Эпштейна-Барра клетками карциномы носоглотки.Кровь. 2009. 113 (9): 1957–66.
CAS PubMed Статья PubMed Central Google Scholar
Maybruck BT, Pfannenstiel LW, Diaz-Montero M, Gastman BR. Экзосомы опухолевого происхождения индуцируют супрессоры CD8 (+) Т-клеток. J Immunother Cancer. 2017; 5 (1): 65.
PubMed PubMed Central Статья Google Scholar
Clayton A, Mitchell JP, Court J, Mason MD, Tabi Z.Экзосомы, происходящие из опухоли человека, избирательно нарушают ответы лимфоцитов на интерлейкин-2. Cancer Res. 2007. 67 (15): 7458–66.
CAS PubMed Статья PubMed Central Google Scholar
Yamada N, Kuranaga Y, Kumazaki M, Shinohara H, Taniguchi K, Akao Y. Внеклеточные везикулы, происходящие из клеток колоректального рака, индуцируют фенотипические изменения Т-клеток в поддерживающие рост опухоли клетки с трансформирующим фактором роста-бета1- опосредованное подавление.Oncotarget. 2016; 7 (19): 27033–43.
PubMed PubMed Central Статья Google Scholar
Szczepanski MJ, Szajnik M, Welsh A, Whiteside TL, Boyiadzis M. Взрывные микровезикулы в сыворотке от пациентов с острым миелоидным лейкозом подавляют функцию естественных клеток-киллеров через мембранно-связанный трансформирующий фактор роста-бета1. Haematologica. 2011. 96 (9): 1302–9.
CAS PubMed PubMed Central Статья Google Scholar
Валенти Р., Хубер В., Филипацци П., Пилла Л., Совена Г., Вилла А и др. Микровезикулы человека, высвобождаемые опухолью, способствуют дифференцировке миелоидных клеток с опосредованной трансформирующим бета фактором роста супрессивной активностью в отношении Т-лимфоцитов. Cancer Res. 2006. 66 (18): 9290–8.
CAS Статья Google Scholar
Xiang X, Poliakov A, Liu C, Liu Y, Deng ZB, Wang J, et al. Индукция миелоидных супрессорных клеток опухолевыми экзосомами.Int J Cancer. 2009. 124 (11): 2621–33.
CAS PubMed PubMed Central Статья Google Scholar
Chalmin F, Ladoire S, Mignot G, Vincent J, Bruchard M, Remy-Martin JP, et al. Связанный с мембраной Hsp72 из опухолевых экзосом опосредует STAT3-зависимую иммуносупрессивную функцию мышиных и человеческих миелоидных супрессорных клеток. J Clin Invest. 2010; 120: 457–71.
CAS PubMed PubMed Central Google Scholar
Дяо Дж., Ян Х, Сонг Х, Чен С., Хе И, Ван Ц. и др. Экзосомный Hsp70 опосредует иммуносупрессивную активность миелоидных клеток-супрессоров посредством фосфорилирования Stat3. Med Oncol. 2015; 32 (2): 453.
PubMed Статья CAS PubMed Central Google Scholar
Шен Й, Го Д., Венг Л., Ван С., Ма З., Ян Й и др. Экзосомы, происходящие из опухоли, обучают дендритные клетки способствовать метастазированию опухоли через путь HSP72 / HSP105-TLR2 / TLR4.Онкоиммунология. 2017; 6 (12): e1362527.
PubMed PubMed Central Статья Google Scholar
Аширу О., Буте П., Фернандес-Мессина Л., Агера-Гонсалес С., Скеппер Дж. Н., Валес-Гомес М. и др. Цитотоксичность естественных клеток-киллеров подавляется воздействием лиганда NKG2D человека MICA * 008, который выделяется опухолевыми клетками в экзосомах. Cancer Res. 2010. 70 (2): 481–9.
CAS PubMed PubMed Central Статья Google Scholar
Инь И, Цай Х, Чен Х, Лян Х, Чжан И, Ли Дж и др. MiR-214, секретируемая опухолью, индуцирует регуляторные Т-клетки: основное звено между уклонением от иммунитета и ростом опухоли. Cell Res. 2014; 24: 1164–80.
CAS PubMed PubMed Central Статья Google Scholar
Mu W, Rana S, Zoller M. Модуляция матрикса хозяина экзосомами опухоли способствует подвижности и инвазивности. Неоплазия. 2013; 15 (8): 875–87.
PubMed PubMed Central Статья CAS Google Scholar
Фонг М.Ю., Чжоу В., Лю Л., Алонтага А.Ю., Чандра М., Эшби Дж. И др. MiR-122, секретируемый раком груди, перепрограммирует метаболизм глюкозы в преметастатической нише, способствуя метастазированию. Nat Cell Biol. 2015; 17 (2): 183–94.
CAS PubMed PubMed Central Статья Google Scholar
Hood JL, Pan H, Lanza GM, Wickline SA. Консорциум трансляционных исследований в области передовой I, наномедицины. Паракринная индукция эндотелия экзосомами опухоли.Lab Investig. 2009. 89 (11): 1317–28.
PubMed Статья PubMed Central Google Scholar
Sedgwick AE, Clancy JW, Olivia Balmert M, D’Souza-Schorey C. Внеклеточные микровезикулы и инвадоподии опосредуют неперекрывающиеся способы инвазии опухолевых клеток. Научный доклад 2015; 5: 14748.
CAS PubMed PubMed Central Статья Google Scholar
Джейкоб А., Линклейтер Е., Бейлесс Б.А., Лайонс Т., Прекерис Р. Роль и регуляция комплекса Rab40b-Tks5 во время образования инвадоподий и инвазии раковых клеток. J Cell Sci. 2016; 129 (23): 4341–53.
CAS PubMed PubMed Central Статья Google Scholar
Сунг Б.Х., Кетова Т., Хошино Д., Зийлстра А., Уивер А.М. Направленное движение клеток через ткани контролируется секрецией экзосом. Nat Commun. 2015; 6: 7164.
CAS PubMed PubMed Central Статья Google Scholar
Sung BH, Weaver AM. Секреция экзосом способствует хемотаксису раковых клеток. Cell Adhes Migr. 2017; 11 (2): 187–95.
CAS Статья Google Scholar
Хон К.В., Абу Н., Аб Муталиб Н.С., Джамал Р. Экзосомы как потенциальные биомаркеры и таргетная терапия при колоректальном раке: мини-обзор.Front Pharmacol. 2017; 8: 583.
PubMed PubMed Central Статья CAS Google Scholar
Пейнадо Х., Алекович М., Лавотшкин С., Матей И., Коста-Силва Б., Морено-Буэно Г. и др. Экзосомы меланомы приучают клетки-предшественники костного мозга к прометастатическому фенотипу посредством MET. Nat Med. 2012. 18 (6): 883–91.
CAS PubMed PubMed Central Статья Google Scholar
Treps L, Perret R, Edmond S, Ricard D, Gavard J. Стволовые клетки глиобластомы секретируют проангиогенный фактор VEGF-A во внеклеточных везикулах. J Внеклеточные везикулы. 2017; 6 (1): 1359479.
PubMed PubMed Central Статья CAS Google Scholar
Hsu YL, Hung JY, Chang WA, Lin YS, Pan YC, Tsai PH и др. Экзосомный miR-23a, секретируемый гипоксическим раком легких, увеличивает ангиогенез и проницаемость сосудов за счет воздействия на пролилгидроксилазу и белок плотных контактов ZO-1.Онкоген. 2017; 36 (34): 4929–42.
CAS PubMed Статья PubMed Central Google Scholar
Zhou W, Fong MY, Min Y, Somlo G, Liu L, Palomares MR, et al. MiR-105, секретируемая раком, разрушает сосудистые эндотелиальные барьеры, способствуя метастазированию. Раковая клетка. 2014; 25 (4): 501–15.
CAS PubMed PubMed Central Статья Google Scholar
Шао И, Чен Т., Чжэн Х, Ян С., Сюй К., Чен Х и др. Небольшие внеклеточные везикулы, происходящие из колоректального рака, создают воспалительную предметастатическую нишу в метастазах в печень. Канцерогенез. 2018; 39 (11): 1368-79.
Hood JL, San RS, Wickline SA. Экзосомы, высвобождаемые клетками меланомы, подготавливают сторожевые лимфатические узлы для метастазирования опухоли. Cancer Res. 2011. 71 (11): 3792–801.
CAS PubMed Статья PubMed Central Google Scholar
Коста-Силва Б., Айелло Н.М., Оушен А.Дж., Сингх С., Чжан Х., Такур Б.К. и др. Экзосомы рака поджелудочной железы инициируют образование дометастатической ниши в печени. Nat Cell Biol. 2015; 17 (6): 816–26.
CAS PubMed PubMed Central Статья Google Scholar
Хосино А., Коста-Силва Б., Шен Т.Л., Родригес Г., Хашимото А., Марк М.Т. и др. Интегрины экзосом опухоли определяют органотропные метастазы. Природа. 2015. 527 (7578): 329–35.
CAS PubMed PubMed Central Статья Google Scholar
Аунг Т., Чапуй Б., Фогель Д., Венцель Д., Опперманн М., Лахманн М. и др. Экзосомный уклонение от гуморальной иммунотерапии при агрессивной B-клеточной лимфоме, модулируемой переносчиком АТФ-кассеты A3. Proc Natl Acad Sci U S. A. 2011; 108 (37): 15336–41.
CAS PubMed PubMed Central Статья Google Scholar
Чираволо V, Хубер V, Ghedini GC, Venturelli E, Bianchi F, Campiglio M и др. Возможная роль экзосом со сверхэкспрессией HER2 в противодействии терапии трастузумабом. J. Cell Physiol. 2012. 227 (2): 658–67.
CAS PubMed Статья PubMed Central Google Scholar
Chen G, Huang AC, Zhang W, Zhang G, Wu M, Xu W. и др. Экзосомный PD-L1 способствует иммуносупрессии и связан с ответом против PD-1.Природа. 2018; 560 (7718): 382–6.
CAS PubMed PubMed Central Статья Google Scholar
Любин Дж. А., Чжан Р. Р., Куо Дж. С.. Внеклеточные везикулы, содержащие PD-L1, способствуют уклонению от иммунитета при глиобластоме. Нейрохирургия. 2018; 83 (3): E98 – e100.
PubMed Статья PubMed Central Google Scholar
Ю.М., Тэннок И.Ф. Ориентация на архитектуру опухоли для содействия проникновению лекарств: новое оружие для борьбы с химиорезистентностью при раке поджелудочной железы? Раковая клетка.2012. 21 (3): 327–9.
CAS PubMed Статья PubMed Central Google Scholar
Роби Р.В., Плучино К.М., Холл М.Д., Фоджо А.Т., Бейтс С.Е., Готтесман М.М. Возвращаясь к роли переносчиков ABC в раке с множественной лекарственной устойчивостью. Нат Рев Рак. 2018; 18 (7): 452–64.
CAS PubMed Статья Google Scholar
Shedden K, Xie XT, Chandaroy P, Chang YT, Rosania GR.Изгнание малых молекул в везикулы, выделяемые раковыми клетками: ассоциация с профилями экспрессии генов и химиочувствительностью. Cancer Res. 2003. 63 (15): 4331–7.
CAS Google Scholar
Федеричи С., Петруччи Ф., Кайми С., Чезолини А., Логоцци М., Борги М. и др. Высвобождение экзосом и низкий pH относятся к структуре устойчивости клеток меланомы человека к цисплатину. PLoS One. 2014; 9 (2): e88193.
PubMed PubMed Central Статья CAS Google Scholar
Сафеи Р., Ларсон Б.Дж., Ченг Т.К., Гибсон М.А., Отани С., Наердеманн В. и др. Аномальный лизосомный трафик и усиленный экзосомальный экспорт цисплатина в устойчивых к лекарствам клетках карциномы яичников человека. Mol Cancer Ther. 2005. 4 (10): 1595–604.
CAS PubMed Статья Google Scholar
Koch R, Aung T, Vogel D, Chapuy B, Wenzel D, Becker S, et al. Ядерный захват за счет ингибирования экспорта экзосом индометацином увеличивает цитостатическую эффективность доксорубицина и пиксантрона.Clin Cancer Res. 2016; 22 (2): 395–404.
CAS PubMed Статья Google Scholar
Ifergan I, Scheffer GL, Assaraf YG. Новые внеклеточные везикулы опосредуют ABCG2-зависимую секвестрацию противоопухолевых лекарственных средств и устойчивость к ним. Cancer Res. 2005. 65 (23): 10952–8.
CAS PubMed Статья Google Scholar
Чапуй Б., Коч Р., Радунски Ю., Коршам С., Чеонг Н., Инагаки Н. и др.Внутриклеточный переносчик ABC A3 придает лейкозным клеткам множественную лекарственную устойчивость за счет секвестрации лекарственного средства лизосомами. Лейкемия. 2008. 22 (8): 1576–86.
CAS PubMed Статья Google Scholar
Коркоран С., Рани С., О’Брайен К., О’Нил А., Пренсипи М., Шейх Р. и др. Устойчивость к доцетакселу при раке простаты: оценка связанных фенотипических изменений и возможности передачи устойчивости через экзосомы. PLoS One. 2012; 7 (12): e50999.
CAS PubMed PubMed Central Статья Google Scholar
Zhang FF, Zhu YF, Zhao QN, Yang DT, Dong YP, Jiang L, et al. Микровезикулы опосредуют перенос Р-гликопротеина в чувствительные к паклитакселу клетки рака яичников человека A2780 человека, обеспечивая устойчивость к паклитакселу. Eur J Pharmacol. 2014; 738: 83–90.
CAS PubMed Статья Google Scholar
Bebawy M, Combes V, Lee E, Jaiswal R, Gong J, Bonhoure A и др. Мембранные микрочастицы опосредуют перенос Р-гликопротеина в чувствительные к лекарствам раковые клетки. Лейкемия. 2009. 23 (9): 1643–9.
CAS PubMed Статья Google Scholar
Torreggiani E, Roncuzzi L, Perut F, Zini N, Baldini N. Мультимодальная передача МЛУ экзосомами при остеосаркоме человека. Int J Oncol. 2016; 49 (1): 189–96.
CAS PubMed Статья Google Scholar
Lu JF, Luk F, Gong J, Jaiswal R, Grau GE, Bebawy M. Микрочастицы опосредуют межклеточный перенос MRP1 и повторное определение путей внутренней резистентности. Pharmacol Res. 2013; 76: 77–83.
CAS Статья Google Scholar
Bhattacharya S, Pal K, Sharma AK, Dutta SK, Lau JS, Yan I.K, et al. С-конец белка, взаимодействующего с GAIP, регулирует биогенез аутофагии и экзосом рака поджелудочной железы посредством метаболических путей.PLoS One. 2014; 9 (12): e114409
Qu Z, Wu J, Luo D, Jiang C, Ding Y. Экзосомы, полученные из клеток HCC, индуцируют устойчивость к сорафенибу в гепатоцеллюлярной карциноме как in vivo, так и in vitro. J Exp Clin Cancer Res. 2016; 35 (1): 159.
PubMed PubMed Central Статья CAS Google Scholar
Велла LJ, Берен А., Коулман Б., Гриннинг Д.В., Хилл А.Ф., Себон Дж. Межклеточная устойчивость к ингибированию BRAF может быть опосредована внеклеточными везикулами, связанными с PDGFRbeta.Неоплазия. 2017; 19 (11): 932–40.
CAS PubMed PubMed Central Статья Google Scholar
Ozawa PMM, Alkhilaiwi F, Cavalli IJ, Malheiros D, de Souza Fonseca Ribeiro EM, Cavalli LR. Внеклеточные везикулы из трижды отрицательных клеток рака молочной железы способствуют пролиферации и лекарственной устойчивости неканцерогенных клеток молочной железы. Лечение рака груди Res. 2018; 172 (3): 713–23.
CAS PubMed PubMed Central Статья Google Scholar
Йошимура А., Муто Г. Функция TGF-бета в подавлении иммунитета. Curr Top Microbiol Immunol. 2011; 350: 127–47.
CAS PubMed Google Scholar
Мартинес В.Г., О’Нил С., Салиму Дж., Бреслин С., Клейтон А., Краун Дж. И др. Устойчивость к противораковым препаратам, направленным на HER2, связана с уклонением от иммунитета в раковых клетках и происходящих из них внеклеточных везикулах. Онкоиммунология. 2017; 6 (12): e1362530.
Хан С., Аспе Дж. Р., Асумен М. Г., Альмагуэль Ф., Одумосу О., Асеведо-Мартинес С. и др. Внеклеточный, проницаемый для клеток сурвивин ингибирует апоптоз, способствуя пролиферативному и метастатическому потенциалу. Br J Рак. 2009. 100 (7): 1073–86.
CAS PubMed PubMed Central Статья Google Scholar
Хан С., Джутзи Дж.М., Аспе Дж. Р., МакГрегор Д. В., Нейди Дж. В., Уолл Н. Р.. Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз.2011; 16 (1): 1–12.
CAS PubMed PubMed Central Статья Google Scholar
Хан С., Джутзи Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А. и др. Экзосомальный сурвивин, полученный из плазмы, вероятный биомаркер для раннего выявления рака простаты. PLoS One. 2012; 7 (10): e46737.
CAS PubMed PubMed Central Статья Google Scholar
Мартинес-Гарсия Д., Манеро-Руперес Н., Кесада Р., Корроди-Грегорио Л., Сото-Серрато В. Терапевтические стратегии, включающие ингибирование сурвивина при раке. Med Res Rev.2018. Https://doi.org/10.1002/med.21547.
Крегер Б.Т., Йохансен Е.Р., Церионе Р.А., Антоньяк М.А. Обогащение сурвивина экзосомами из клеток рака молочной железы, обработанных паклитакселом, способствует выживанию клеток и химиорезистентности. Раки (Базель). 2016; 8 (12).
Акао Й, Кху Ф, Кумадзаки М, Шинохара Х, Мики К., Ямада Н.Внеклеточное удаление опухолевых супрессоров miRs-145 и -34a через микровезикулы и устойчивость к 5-ФУ клеток рака толстой кишки человека. Int J Mol Sci. 2014; 15 (1): 1392–401.
PubMed PubMed Central Статья CAS Google Scholar
Bouvy C, Wannez A, Laloy J, Chatelain C, Dogne JM. Передача множественной лекарственной устойчивости среди клеток острого миелоидного лейкоза через внеклеточные везикулы и их груз микроРНК. Leuk Res. 2017; 62: 70–6.
CAS PubMed Статья PubMed Central Google Scholar
Биненбаум Ю., Фридман Э., Яари З., Мильман Н., Шредер А., Бен Дэвид Г. и др. Перенос миРНК в экзосомах, происходящих из макрофагов, вызывает лекарственную устойчивость аденокарциномы поджелудочной железы. Cancer Res. 2018; 78 (18): 5287–99.
CAS PubMed Статья PubMed Central Google Scholar
Hu Y, Yan C, Mu L, Huang K, Li X, Tao D, et al. Экзосомы, полученные из фибробластов, способствуют повышению химиорезистентности за счет прайминга раковых стволовых клеток при колоректальном раке. PLoS One. 2015; 10 (5): e0125625.
Au Yeung CL, Co NN, Tsuruga T., Yeung TL, Kwan SY, Leung CS, et al. Экзосомный перенос miR21, происходящего из стромы, придает устойчивость к паклитакселу в раковых клетках яичников посредством нацеливания на APAF1. Nat Commun. 2016; 7: 11150.
PubMed PubMed Central Статья CAS Google Scholar
Zheng P, Chen L, Yuan X, Luo Q, Liu Y, Xie G и др. Экзосомный перенос miR-21, полученного из связанных с опухолью макрофагов, придает устойчивость к цисплатину в клетках рака желудка. J Exp Clin Cancer Res. 2017; 36 (1): 53.
PubMed PubMed Central Статья CAS Google Scholar
Boelens MC, Wu TJ, Nabet BY, Xu B, Qiu Y, Yoon T, et al. Перенос экзосом из стромальных клеток в клетки рака молочной железы регулирует пути резистентности к терапии.Клетка. 2014. 159 (3): 499–513.
CAS PubMed PubMed Central Статья Google Scholar
Цзи Р., Чжан Б., Чжан Х, Сюэ Дж, Юань Х, Янь И и др. Экзосомы, полученные из мезенхимальных стволовых клеток человека, придают лекарственную устойчивость при раке желудка. Клеточный цикл. 2015; 14 (15): 2473–83.
CAS PubMed PubMed Central Статья Google Scholar
Петрова В., Анниккиарико-Петруцелли М., Мелино Г., Амелио И. Микроокружение гипоксической опухоли. Онкогенез. 2018; 7 (1): 10.
Dorayappan KDP, Wanner R, Wallbillich JJ, Saini U, Zingarelli R, Suarez AA, et al. Экзосомы, индуцированные гипоксией, вносят вклад в более агрессивный и устойчивый к химиотерапии фенотип рака яичников: новый механизм, связывающий белки STAT3 / Rab. Онкоген. 2018. 37 (28): 3806–21.
CAS PubMed PubMed Central Статья Google Scholar
Bandari SK, Purushothaman A, Ramani VC, Brinkley GJ, Chandrashekar DS, Varambally S, et al. Химиотерапия вызывает секрецию экзосом, загруженных гепараназой, которая разрушает внеклеточный матрикс и влияет на поведение опухоли и клеток-хозяев. Matrix Biol. 2018; 65: 104–18.
CAS PubMed Статья PubMed Central Google Scholar
Lv LH, Wan YL, Lin Y, Zhang W, Yang M, Li GL и др. Противораковые препараты вызывают высвобождение экзосом с белками теплового шока из клеток гепатоцеллюлярной карциномы человека, которые вызывают эффективные противоопухолевые реакции естественных клеток-киллеров in vitro.J Biol Chem. 2012. 287 (19): 15874–85.
CAS PubMed PubMed Central Статья Google Scholar
Roseblade A, Luk F, Ung A, Bebawy M. Нацеливание на биогенез микрочастиц: новый подход к обходу множественной лекарственной устойчивости рака. Curr Cancer Drug Targets. 2015; 15 (3): 205–14.
CAS PubMed Статья PubMed Central Google Scholar
Jorfi S, Ansa-Addo EA, Kholia S, Stratton D, Valley S, Lange S и др. Ингибирование микровезикуляции повышает чувствительность клеток рака простаты к химиотерапии и снижает дозу доцетаксела, необходимую для ограничения роста опухоли in vivo. Научный доклад 2015; 5: 13006.
CAS PubMed PubMed Central Статья Google Scholar
Muralidharan-Chari V, Kohan HG, Asimakopoulos AG, Sudha T, Sell S, Kannan K, et al. Удаление микровезикул противоопухолевыми препаратами способствует развитию лекарственной устойчивости раковых клеток поджелудочной железы человека.Oncotarget. 2016; 7 (31): 50365–79.
PubMed PubMed Central Статья Google Scholar
Холия С., Джорфи С., Томпсон П.Р., Кози С.П., Николас А.П., Инал Дж. М. и др. Новая роль пептидиларгининдезиминаз в высвобождении микровезикул показывает терапевтический потенциал ингибирования PAD в повышении чувствительности клеток рака простаты к химиотерапии. J Внеклеточные везикулы. 2015; 4: 26192.
PubMed Статья CAS Google Scholar
Kosgodage США, Trindade RP, Thompson PR, Inal JM, Lange S. Опосредованное хлорамидином / бисиндолилмалеимидом I ингибирование высвобождения экзосом и микровезикул и повышенная эффективность химиотерапии рака. Int J Mol Sci. 2017; 18 (5).
Kosgodage US, Mold R, Henley AB, Nunn AV, Guy GW, Thomas EL, et al. Каннабидиол (CBD) — новый ингибитор высвобождения экзосом и микровезикул (EMV) при раке. Front Pharmacol. 2018; 9: 889.
PubMed PubMed Central Статья CAS Google Scholar
Таллис Р. Х., Даффин Р. П., Хэндли Х. Х., Соди П., Менон Дж., Джойс Дж. А. и др. Уменьшение вируса гепатита С с помощью лектинового плазмафереза у диализных пациентов. Blood Purif. 2009. 27 (1): 64–9.
CAS PubMed Статья PubMed Central Google Scholar
Марло AM, Chen CS, Joyce JA, Tullis RH. Удаление экзосом как терапевтический адъювант при раке. J Transl Med. 2012; 10: 134.
CAS PubMed PubMed Central Статья Google Scholar
Qin X, Yu S, Zhou L, Shi M, Hu Y, Xu X и др. Экзосомы, происходящие из клеток устойчивого к цисплатину рака легкого, повышают устойчивость клеток-реципиентов к цисплатину экзосомальным miR-100-5p-зависимым образом. Int J Nanomedicine. 2017; 12: 3721–33.
CAS PubMed PubMed Central Статья Google Scholar
Wei F, Ma C, Zhou T, Dong X, Luo Q, Geng L, et al. Экзосомы, полученные из устойчивых к гемцитабину клеток, передают злокачественные фенотипические признаки посредством доставки miRNA-222-3p.Молочный рак. 2017; 16 (1): 132.
PubMed PubMed Central Статья CAS Google Scholar
Wu H, Zhou J, Mei S, Wu D, Mu Z, Chen B, et al. Циркулирующая экзосомальная микроРНК-96 способствует пролиферации, миграции и устойчивости клеток к лекарствам, воздействуя на LMO7. J Cell Mol Med. 2017; 21: 1228–36.
CAS PubMed Статья PubMed Central Google Scholar
Yuwen DL, Sheng BB, Liu J, Wenyu W., Shu YQ. Уровень MiR-146a-5p в экзосомах сыворотки позволяет прогнозировать терапевтический эффект цисплатина при немелкоклеточном раке легкого. Eur Rev Med Pharmacol Sci. 2017; 21 (11): 2650–8.
PubMed PubMed Central Google Scholar
Chen WX, Cai YQ, Lv MM, Chen L, Zhong SL, Ma TF, et al. Экзосомы из устойчивых к доцетакселу клеток рака молочной железы изменяют химиочувствительность, доставляя микроРНК. Tumor Biol.2014. 35 (10): 9649–59.
CAS PubMed Статья PubMed Central Google Scholar
Wei Y, Lai X, Yu S, Chen S, Ma Y, Zhang Y, et al. Экзосомный miR-221/222 увеличивает устойчивость к тамоксифену в ER-положительных клетках рака молочной железы. Лечение рака груди Res. 2014. 147 (2): 423–31.
CAS Статья Google Scholar
О’Брайен К., Лоури М.С., Коркоран С., Мартинес В.Г., Дейли М., Рани С. и др.miR-134 во внеклеточных везикулах снижает агрессивность тройного отрицательного рака молочной железы и повышает чувствительность к лекарствам. Oncotarget. 2015; 6 (32): 32774–89.
PubMed PubMed Central Google Scholar
Santos JC, Lima NDS, Sarian LO, Matheu A, Ribeiro ML, Derchain SFM. Опосредованная экзосомами химиорезистентность к раку молочной железы через перенос miR-155. Научный доклад 2018; 8 (1): 829.
PubMed PubMed Central Статья CAS Google Scholar
Li XJ, Ren ZJ, Tang JH, Yu Q. Экзосомная микроРНК MiR-1246 способствует пролиферации клеток, инвазии и устойчивости к лекарствам, воздействуя на CCNG2 при раке молочной железы. Cell Physiol Biochem. 2017; 44 (5): 1741–8.
CAS PubMed Статья PubMed Central Google Scholar
Yu DD, Wu Y, Zhang XH, Lv MM, Chen WX, Chen X и др. Экзосомы из устойчивых к адриамицину клеток рака молочной железы передают устойчивость к лекарствам частично за счет доставки miR-222.Tumor Biol. 2016; 37 (3): 3227–35.
CAS PubMed Статья PubMed Central Google Scholar
Лю Т., Чен Дж., Сунь Д., Лей М., Ли Й, Чжоу С. и др. Экзосомы, содержащие miR-21, передают характеристику устойчивости к цисплатину, воздействуя на PTEN и PDCD4 при плоскоклеточной карциноме полости рта. Acta Biochim Biophys Sin Shanghai. 2017; 49 (9): 808–16.
CAS PubMed Статья PubMed Central Google Scholar
Лунават Т.Р., Ченг Л., Эйнарсдоттир Б.О., Олофссон Багге Р., Веппил Муралидхаран С., Шарплс Р.А. и др. Ингибирование BRAF (V600) изменяет груз микроРНК в везикулярном секрете клеток злокачественной меланомы. Proc Natl Acad Sci U S. A. 2017; 114 (29): E5930 – e9.
CAS PubMed PubMed Central Статья Google Scholar
Ян Дж. К., Ян Дж. П., Тонг Дж., Цзин С.И., Фан Б., Ван Ф. и др. Экзосомный miR-221 нацелен на DNM3, чтобы вызвать прогрессирование опухоли и резистентность к темозоломиду в глиоме.J Neuro-Oncol. 2017; 131 (2): 255–65.
CAS Статья Google Scholar
Corcoran C, Rani S, O’Driscoll L. miR-34a представляет собой внутриклеточный и экзосомный прогностический биомаркер ответа на доцетаксел с клиническим значением для прогрессирования рака простаты. Простата. 2014. 74 (13): 1320–34.
CAS PubMed Статья PubMed Central Google Scholar
Микамори М., Ямада Д., Эгути Х., Хасэгава С., Кисимото Т., Томимару Ю. и др. MicroRNA-155 контролирует синтез экзосом и способствует устойчивости к гемцитабину при аденокарциноме протоков поджелудочной железы. Научный отчет 2017; 7: 42339.
CAS PubMed PubMed Central Статья Google Scholar
Min QH, Wang XZ, Zhang J, Chen QG, Li SQ, Liu XQ, et al. Экзосомы, полученные из устойчивых к иматинибу клеток хронического миелоидного лейкоза, опосредуют горизонтальный перенос признака устойчивости к лекарствам путем доставки miR-365.Exp Cell Res. 2018; 362 (2): 386–93.
CAS PubMed Статья PubMed Central Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Специализация межклеточных переходов в базальноклеточной карциноме человека
Алрой, Дж., Вайнштейн, Р.С.: Необычные комплексы межклеточных переходов в аденоакантомах молочной железы собак. J. Natl. Cancer Inst. 56 , 667–670 (1976)
Google Scholar
Баннер, Б., Алрой, Дж., Паули, Б., Карпентер, Дж .: Ультраструктурное исследование ацино-клеточного рака поджелудочной железы собак. Являюсь. Дж. Патол, 93 , 165–182 (1978)
Google Scholar
Брантон, Д., Булливант, С., Гилула, Н., Карновски, М., Мур, Х., Мултхалер, К., Норткот, Д., Пакер, Л., Сатир, Б., Сатир , П., Спет, В., Стахлин, Л.А., Стир, Р. и Вайнштейн, Р.: Номенклатура замораживания-травления. Наука 190 , 54–56 (1975)
Google Scholar
Бретнах, А.С .: Атлас ультраструктуры кожи человека. Лондон: Дж. И А. Черчилль, 1971
Google Scholar
Капуто Р., Пелучетти Д .: Соединения нормального эпидермиса человека. J. Ultrastruct. Res. 61 , 44–61 (1977)
Google Scholar
Купер, М., Пинкус, Х .: Внутриутробная трансплантация базальноклеточной карциномы крысы как модель реконверсии злокачественного роста в доброкачественный.Cancer Res. 37 , 2544–2552 (1977)
Google Scholar
Элиас П.М., Френд Д.С.: барьер проницаемости в эпидермисе млекопитающих. J. Cell Biol. 65 , 180–191 (1975)
Google Scholar
Флаксман, Б., Ван Скотт, Э .: Кератинизация in vitro клеток базальноклеточной карциномы. J. Natl. Cancer Inst. 40 , 411–422 (1968)
Google Scholar
Флаксман, Б.: Рост in vitro и индукция дифференцировки в клетках базальноклеточного рака. Cancer Res. 32 , 462–469 (1972)
Google Scholar
Флаксман, Б., Кавото, Ф .: Соединения с низким сопротивлением в эпителиальных выростах нормального и злокачественного эпидермиса in vitro. J. Cell Biol. 58 , 219–233 (1973)
Google Scholar
Gilula, N.B .: Щелевые соединения и сотовая связь.В: Международная клеточная биология, Бринкли, Б. и Портер, К. (ред.). п. 61. Нью-Йорк: Rockefeller University Press, 1977
Google Scholar
Гуденаф Д.А., Пол Д., Калберт К .: Корреляционная ультраструктура щелевого перехода. В: Молекулярные основы межклеточного взаимодействия. Врожденные дефекты. Серия оригинальных статей, 14 , 83 (1978)
Google Scholar
Хашимото, К.: Ультраструктура кожи с морозными переломами. J. Invest. Derm. 60 , 250–251 (1973)
Google Scholar
Джонсон, Р.Г., Шеридан, Дж.Д .: Соединения между раковыми клетками в культуре: ультраструктура и проницаемость. Наука 174 , 717–719 (1971)
Google Scholar
Керр, Дж., Сирл, Дж .: Предлагаемое объяснение парадоксально медленной скорости роста базальноклеточных карцином, содержащих многочисленные митотические фигуры.J. Path. 107 , 41–44 (1972)
Google Scholar
Кинт, А .: Гистогенетическое исследование базальноклеточной эпителиомы. Curr. Пробл. Derm. 3 , 82–123 (1970)
Google Scholar
Krompecher, E .: Der Basalzellkrebs. Йена: Фишер 1903
Google Scholar
Лэрд, А .: Динамика роста опухолей и нормальных организмов.В: Кинетика опухолевых клеток человека (Монография Национального института рака № 30), С. Перри (ред.), Стр. 15. Bethesda: Национальный институт рака, 1969
Google Scholar
Lapis, K .: Базальноклеточный рак века и периорбитальной области. Acta Morphologica Acad. Sci. Повесили. 24 , 381–400 (1976)
Google Scholar
Лоуренс, Т.С., Бирс, В., Гилула, Н.Б .: Передача гормональной стимуляции посредством межклеточной коммуникации. Природа 272 , 501–506 (1978)
Google Scholar
Левенштейн, W.R .: Возникновение порядка в тканях и органах. Связь через соединения ячеек. Последствия для контроля роста и дифференциации. Развивать. Биол. Дополнение 2 , 151–180 (1968)
Google Scholar
Левенштейн, В.Р .: Некоторые размышления о росте и дифференциации. Перспектива. Биол. Med. 11 , 260–272 (1968)
Google Scholar
МакНатт, Н.С., Вайнштейн, Р .: Ультраструктура взаимосвязи. Коррелированное исследование тонких срезов и замораживания-скалывания. J. Cell Biol. 47 , 666–688 (1970)
Google Scholar
МакНатт, Н.С., Вайнштейн, Р .: Ультраструктура мембраны в межклеточных соединениях млекопитающих.Прогр. Биофиз. Мол. Биол. 26 , 45–100 (1973)
Google Scholar
Мейер, Р., Посалаки, З., МакГинли, Д .: Развитие межклеточных соединений в семенных канальцах созревающих крыс. J. Ultrastruct. Res. 61 , 271–283 (1977)
Google Scholar
Mohs, F.E .: Химиохирургия рака кожи. Arch. Дерматол. 112 , 211–215 (1976)
Google Scholar
Паули, Б., Коэн, С., Алрой, Дж., Вайнштейн, Р.: Ультраструктура десмосом и биологическое поведение канцероген-индуцированной карциномы мочевого пузыря. Cancer Res. 38 , 3276–3285 (1978)
Google Scholar
Пинто да Силва, П., Гилула, Н.Б .: Щелевые соединения в нормальных и трансформированных фибробластах в культуре. Exptl. Cell Res. 71 , 393–401 (1972)
Google Scholar
Питтс, Дж.Д .: Прямое общение между клетками животных. В: Международная клеточная биология, Бринкли, Б. и Портер, К. (ред.), Стр. 43. New York: Rockefeller University Press 1977
Google Scholar
Potter, B.D., Furshpan, E.J., Lennox, E.S .: Связи между клетками развивающихся кальмаров, выявленные электрофизиологическими методами. Proc. Natl. Акад. Sci. США 55 , 328–335 (1966)
Google Scholar
Ревель, Дж.П .: Морфологическая и химическая организация щелевых контактов. Symp. 9-е межд. Congr. Электр. Микроскопия 651–658, 1978
Сафари Б., Гуд Р.А .: Базальноклеточная карцинома с метастазами, Arch. Патол. Лаборатория. Med. 101 , 327–329 (1977)
Google Scholar
Шеридан, J.D .: Сцепление клеток и коммуникация клеток во время эмбриогенеза. В: Поверхность клеток в эмбриогенезе и развитии животных, Poste, G., и Николсон, Г. (ред.), стр. 409. Амстердам: Эльзевир / Северная Голландия 1976
Google Scholar
Шимоно, М., Клементи, Ф .: Межклеточные соединения орального эпителия. J. Ultrastruct. Res. 56 , 121–136 (1976)
Google Scholar
Симпсон, И., Роуз, Б., Левенштейн, У.Р .: Предел размера молекул, проникающих в соединительные каналы. Наука 195 , 294–296 (1977)
Google Scholar
Синха, А., Бентли, М., Блэкард, К.: Наблюдения за замораживанием переломов мембран и соединений при раке предстательной железы человека и доброкачественной гипертрофии предстательной железы. Рак 40 , 1182–1188 (1977)
Google Scholar
Слоан, Дж. П .: Значение типирования базальноклеточных карцином в прогнозировании рецидива после хирургического удаления. Br. J. Derm. 96 , 127–132 (1977)
Google Scholar
Стаэелин, Л.А .: Строение и функция межклеточных контактов. Междунар. Rev. Cytol. 39 , 191–283 (1974)
Google Scholar
Staehelin, L.A., Hull, B.E .: Соединения между живыми клетками. Sci. Являюсь. 238 , 140–152 (1978)
Google Scholar
Уэйд Т.Р., Акерман А.Б .: Многоликая карцинома базальных клеток. J. Derm. Surg. Onc. 4 , 23–28 (1978)
Google Scholar
Вайнштейн, Г., Фрост, П .: Клеточная пролиферация базальноклеточной карциномы человека. Cancer Res. 30 , 724–728 (1970)
Google Scholar
Weinstein, R.S., Merk, F.B. Алрой, Дж .: Структура и функция межклеточных соединений при раке. В: «Достижения в исследованиях рака», Кляйн, Дж., Вайнхаус, С., и Хаддоу, А. (ред.), Нью-Йорк, Лондон: Academic Press, 1976,
. Google Scholar
Циркулирующая растворимая межклеточная адгезия Молекула-1 при раке легких: систематический обзор — Gu
Введение
Рак легких является ведущей причиной смерти от злокачественных новообразований во всем мире.Несмотря на успехи в диагностических и терапевтических методах, прогноз пациентов с раком легких все еще оставляет желать лучшего: общая 5-летняя выживаемость составляет примерно 15% (1). Чрезвычайно плохой прогноз, связанный с раком легких, связан с трудностью ранней диагностики и высокой частотой региональных или отдаленных метастазов. Однако взаимодействие между опухолевыми клетками и эндотелием сосудов имеет важное значение для метастазирования опухоли (2). Считается, что молекула межклеточной адгезии-1 (ICAM-1) играет важную роль на определенных этапах метастатического процесса при злокачественных заболеваниях (3,4).
ICAM-1, член семейства супергенных иммуноглобулинов, представляет собой одноцепочечный гликопротеин клеточной поверхности, который конститутивно экспрессируется на низких уровнях на разных типах клеток (5). Молекулярное взаимодействие между ICAM-1 и его лигандом, антигеном, ассоциированным с функцией лимфоцитов, интегрином лейкоцитов (LFA-1), является решающим этапом трансэндотелиальной миграции лейкоцитов. Более того, цитокин-индуцированная экспрессия ICAM-1 может сделать опухолевые клетки более чувствительными к лизису, опосредованному моноцитами и Т-клетками (6,7).Растворимая форма ICAM-1 (sICAM-1) была впервые идентифицирована в сыворотке здоровых добровольцев Сетом и др. (8). Хотя sICAM-1 меньше, чем его мембраносвязанная форма, его пять иммуноглобулин-подобных доменов и его способность связываться с LFA-1 являются консервативными (9). Таким образом, sICAM-1 может связываться с циркулирующими цитотоксическими лимфоцитами, блокировать взаимодействие между опухолевыми клетками и APC- или Т-лимфоцитами и, таким образом, позволять опухолям избегать иммунного распознавания (10). Кроме того, Gho et al. (11,12) сообщил, что sICAM-1, по-видимому, обладает способностью стимулировать ангиогенез и стимулировать рост опухолевых клеток.Повышенные уровни sICAM-1 были зарегистрированы у пациентов с различными злокачественными новообразованиями, и, тем не менее, это коррелирует с прогрессированием заболевания и метастазированием опухоли (10,13,14).
В нескольких исследованиях у пациентов с раком легких сообщалось о наличии повышенных уровней sICAM-1 и взаимосвязи между его концентрацией и клиническим исходом, а также с клинико-патологическими характеристиками, включая статус эффективности ECOG, пол, возраст, историю курения, гистологический тип. , стадия опухоли и другие (15-18).Хотя эти предметы изучались более десяти лет, консенсуса достигнуто не было, и в различных исследованиях были получены некоторые противоречивые результаты. В этом обзоре мы суммируем, насколько это возможно, результаты этих исследований рака легких и в основном сосредоточимся на следующих четырех аспектах: (I). сравнение уровней sICAM-1 у пациентов с раком легких и здоровых людей в контрольной группе (II). взаимосвязь между уровнями sICAM-1 и клинико-патологическими характеристиками пациентов с раком легких (III).изменение уровней sICAM-1 во время курсов лечения, (IV). прогностическое значение уровней sICAM-1 при раке легких.
Методы
Стратегия поиска и выбор исследований
Чтобы просмотреть литературу о sICAM-1 и раке легких, мы провели поиск в электронных базах данных (включая PubMed, Web of Science и Medline) с терминами «ICAM», «молекула межклеточной адгезии» и «рак легкого». , с поиском, ограниченным заголовком или аннотацией.И был применен верхний предел даты 6 июля 2011 года; мы не использовали нижний предел даты. Мы также проверили списки литературы из определенных первичных исследований, чтобы определить любые исследования, которые оказались подходящими для этого обзора.
Исследования, подходящие для включения в этот обзор, соответствовали следующим критериям: (I) подтвержденный диагноз рака легких у людей, (II) оценка циркулирующих уровней sICAM-1 и (III) предоставление информации по крайней мере об одном из четырех вышеупомянутых аспекты. Особых требований в отношении размера выборки или периода наблюдения не было.Когда один и тот же автор опубликовал несколько рукописей и использовал перекрывающиеся когорты пациентов, в этот обзор был включен только самый последний или самый полный отчет. Отчеты в журналах, к которым было трудно получить доступ, также были исключены для детального просмотра. Все статьи-кандидаты были независимо прочитаны и проверены на соответствие критериям включения двумя исследователями (xiaoling GU и chunyan MA). Разногласия разрешались консенсусом.
Извлечение данных
Два исследователя (Сяолин Гу и Чуньян Ма) независимо извлекли необходимую информацию из заключительных статей.Данные, полученные из отчетов, включали следующее: (I) основная информация о первичном исследовании, включая автора, размер выборки, стратегию лечения, время сбора образца, метод тестирования, пороговое значение, (II) данные опухоли, включая тип гистологии, стадию заболевания, (III) результаты, представленные в первичном исследовании, включая данные о выживаемости, частоте ответа, концентрации sICAM-1 до и после лечения, а также ее взаимосвязь с клинико-патологическими характеристиками. Если данные из любой из вышеперечисленных категорий не были представлены в первичном исследовании, элементы считались «не сообщенными».«С авторами первичных исследований не связались по поводу незарегистрированных данных.
Результаты
Выбор исследования
Используя описанные стратегии поиска, в период с сентября 1992 г. по июнь 2011 г. было получено 136 потенциально релевантных ссылок. Из 136 первичных исследований 16 исследований попали в раздел выбора исследований ( Рисунок 1 ). В общей сложности было включено 1258 пациентов, начиная с От 12 до 150 пациентов на исследование.Все оставшиеся исследования содержали информацию по крайней мере об одном из четырех аспектов, исследованных в этом обзоре. Основные характеристики 16 подходящих исследований перечислены в таблицах (1,3–5. И если в исследованиях представлены данные по более чем одному из четырех аспектов, они будут перечислены более одного раза.
Рисунок 1 Блок-схема стратегии поиска.
Сравнение уровней sICAM-1 между пациентами и контрольной группой
Согласно нашему поиску в литературе, в 10 опубликованных исследованиях сравнивались исходные уровни sICAM-1 в крови у пациентов с раком легких и здоровых контрольных групп (, таблица 1, ).Хотя эти публикации были посвящены нескольким различным когортам пациентов (восемь исследований включают различные стадии рака легких, а три исследования включают как SCLC, так и NSCLC), все десять первичных исследований (15-24) выявили циркулирующую концентрацию sICAM-1 у пациентов с раком легких. значительно увеличился по сравнению со здоровым контролем (, таблица 1, ). Кроме того, Grothey A (17) и Taguchi O (23) сообщили, что уровни sICAM-1 у пациентов с локализованным заболеванием, даже на стадии I, также были значительно выше, чем в контроле.Этот результат, по-видимому, указывает на то, что стимуляция секреции ICAM-1 начинается на ранней клинической стадии рака легких.
Таблица 1 Сравнение уровней sICAM-1 между пациентами и контрольной группойПолная таблица
Связь между уровнями sICAM-1 и клинико-патологическими характеристиками
Среди 16 заключительных статей 11 публикаций исследовали связь между исходными уровнями sICAM-1 и клинико-патологическими характеристиками, включая статус работы по ECOG, возраст, пол, историю курения, стадию заболевания, тип гистологии (, таблица 2, ).В большинстве этих исследований не наблюдалось значительных различий в концентрации циркулирующего sICAM-1 в отношении статуса производительности ECOG (16,22,25), возраста (15-19,22,25), пола (15,16,18,22,25) или история курения (17-19,22,26). Однако последнее исследование Qian Q (15) с участием 124 пациентов с неоперабельным НМРЛ показало, что исходные уровни sICAM-1 в сыворотке значимо связаны со статусом работоспособности (P = 0,011). Кроме того, Kamiyoshihara M (19) сообщил, что уровни sICAM-1 в группе пациентов-мужчин были значительно выше, чем в группе пациентов-женщин (P = 0.0036), и они не наблюдали каких-либо существенных различий между фоном самцов и самок. Однако доказательств недостаточно, чтобы прояснить взаимосвязь между уровнями sICAM-1, статусом производительности и полом.
Таблица 2 Корреляция между уровнями sICAM-1 и клинико-патологическими характеристикамиПолная таблица
10 заключительных статей исследовали связь между исходными уровнями sICAM-1 и стадиями заболевания (, таблица 2, ).И Shin HS (26), и Gogali A (24) не наблюдали значительной разницы в концентрации sICAM-1 среди пациентов с SCLC с разными стадиями заболевания. Однако из девяти исследований (15-19,21,22,24,26), оценивающих взаимосвязь между концентрацией sICAM-1 и стадиями заболевания НМРЛ, три исследования выявили достоверно положительную корреляцию между этими двумя переменными (15,21,22). ). Кроме того, в нескольких исследованиях (18,19) сообщается, что концентрация циркулирующего sICAM-1 у пациентов с болезнью T2 、 N2 была значительно повышена по сравнению с таковой при заболевании T1 N0, соответственно.Кроме того, Grothey A (17) показал, что пациенты с метастатическими заболеваниями имели значительно более высокие уровни sICAM-1 по сравнению с другими группами (P = 0,0013). Таким образом, по-видимому, существует положительная корреляция между исходными уровнями sICAM-1 и стадиями заболевания НМРЛ.
В девяти исследованиях изучалась взаимосвязь между исходными уровнями sICAM-1 и гистологическими типами. Эти исследования не выявили статистической разницы между SCLC и NSCLC (23,24,26), а также между аденкарциномой и плоскоклеточной карциномой (15-19,23,26).Однако исследования Grothey A (17) и Kamiyoshihara M (19) наблюдали тенденцию к более высоким уровням плоскоклеточного рака, в то время как Osaki T (18) сообщил, что концентрация sICAM-1 в сыворотке крови была значительно выше у пациентов с плоскоклеточным раком по сравнению с крупноклеточной карциномой. (P = 0,0146). Таким образом, уровень sICAM-1, по-видимому, выше при плоскоклеточном раке.
Изменения уровней sICAM-1 до и после лечения
В восьми исследованиях проводились серийные оценки sICAM-1 до и после лечения (, таблица 3, ).Из них две статьи показали, что уровни sICAM-1 у пациентов с МРЛ существенно не изменились после лечения комбинированной химиотерапией (27,28). Однако четыре из пяти исследований, посвященных НМРЛ (15,16,21,22), показали, что уровни циркулирующего sICAM-1 значительно снизились во время курса лечения. Кроме того, как описано ниже, по-видимому, существует значительно обратная связь между уровнями sICAM-1 в крови и скоростью ответа при распространенном НМРЛ. Таким образом, снижение уровней sICAM-1 может быть связано с механизмом действия цитотоксических препаратов или с биологией НМРЛ.Однако необходимы более глубокие исследования, чтобы понять природу этой проблемы.
Таблица 3 Сравнение уровней sICAM-1 до и после леченияПолная таблица
Прогностическое значение уровней sICAM-1 при раке легких
Согласно нашему поиску литературы, 9 опубликованных исследований сообщили о прогностическом влиянии уровней sICAM-1 (, таблица 4, ). И, по-видимому, существует значительно обратная связь между уровнями sICAM-1 и выживаемостью у пациентов с НМРЛ.Однако прогностическая ценность sICAM-1 у пациентов с МРЛ не была широко исследована.
Таблица 4 Прогностическая ценность циркулирующего sICAM-1 у пациентов с раком легкогоПолная таблица
Прогностическое влияние sICAM-1 на выживаемость
Из 6 исследований (16-18,25,26,28,29), оценивающих прогностическое влияние на общую выживаемость (ОВ), два исследования выявили значительно обратную связь между исходными уровнями sICAM-1 и ОВ пациентов с НМРЛ (25,26) .Исследование Osaki T (18) также имело тенденцию к плохой ОС при высоких исходных уровнях sICAM-1 со значением P 0,1759. Однако еще два исследования (16,17) продемонстрировали, что sICAM-1, полученный до лечения, не был прогностическим фактором в отношении общей выживаемости при НМРЛ. Это может быть связано с небольшим размером выборки. В то время как при обращении к SCLC, Horn L (28) сообщил, что пациенты с более низкими уровнями sICAM-1 имели тенденцию к более высокому риску смерти (HR = 0,48; 95% ДИ, 0,22–1,02; P = 0,067). В исследовании Shin HS (26) не наблюдалось какого-либо значительного влияния sICAM-1 на ОС у пациентов с SCLC.Это может отражать разницу в биологии между SCLC и NSCLC.
Кроме того, Sprenger A (29) продемонстрировал тенденцию к снижению выживаемости (8 месяцев по сравнению с 12 месяцами) у пациентов с повышением уровня sICAM-1 во время курсов лечения, хотя разница (P = 0,14) не достигла значимого уровня.
Прогностическое влияние sICAM-1 на выживаемость без прогрессирования заболевания
В трех исследованиях оценивали прогностическое влияние уровней sICAM-1 до лечения на выживаемость без прогрессирования заболевания (ВБП).Qian Q (15) сообщил о значительно обратной связи между уровнями sICAM-1 и ВБП при распространенном НМРЛ, в то время как исследование Dowlati A (25) имело тенденцию к плохой ВБП при высоких уровнях sICAM-1 (P = 0,081). В то время как Horn L (28) сообщил, что пациенты с SCLC с более низкими уровнями sICAM-1 демонстрировали небольшую тенденцию к более высокому риску прогрессирования заболевания (HR = 0,75; P = 0,44).
Кроме того, исследование Qian Q (15) продемонстрировало, что пациенты с распространенным НМРЛ, у которых наблюдалось более значительное снижение уровня sICAM-1, выживали значительно дольше, чем пациенты, у которых этого не было.Принимая во внимание, что Hanrahan EO (30) сообщил, что увеличение sICAM-1 было связано со снижением риска прогрессирования (, таблица 4, ). Эти противоположные результаты, вероятно, были связаны с различием стратегии лечения, а также времени сбора образцов.
Прогностическая ценность уровней sICAM-1 при раке легких
В трех опубликованных исследованиях сообщается о прогностической ценности повышенных исходных уровней sICAM-1 (, таблица 5, ). Из них 2 выявили значительную обратную связь между циркулирующими уровнями sICAM-1 и скоростью ответа при распространенном НМРЛ (15,25), в то время как другое исследование Horn L (28) показало, что исходные уровни sICAM-1 существенно не коррелировали с ответ на химиотерапию у пациентов с SCLC.Кроме того, следует отметить, что исследование Qian Q (15) продемонстрировало, что пациенты, у которых наблюдалось более значительное снижение уровня sICAM-1 во время курсов лечения, имели заметно более высокий уровень ответа.
Таблица 5 Прогностическая ценность циркулирующего sICAM-1 у пациентов с раком легкогоПолная таблица
Обсуждение
Известно, чтоICAM-1 участвует в прогрессировании опухоли и воспалительном взаимодействии путем связывания с лигандами β2-интегрина LFA-1 (CD11a / CD18) и MAC-1 (CD11b / CD18) (31).Поскольку растворимая форма ICAM-1 (sICAM-1) была впервые обнаружена в сыворотке здоровых людей в 1991 году, ее исследовали при различных злокачественных новообразованиях. Этот обзор литературы суммирует часть большого количества опубликованных исследований, демонстрирующих клиническое значение sICAM-1 при раке легких. И мы обнаружили: (I) циркулирующая концентрация sICAM-1 у пациентов с раком легких значительно увеличилась по сравнению со здоровыми людьми из контрольной группы; (II) Исходные уровни sICAM-1, по-видимому, были связаны с клинико-патологическими характеристиками, включая статус ECOG, пол, стадию заболевания и тип гистологии; (III) уровни sICAM-1, по-видимому, могут предсказать исход у пациентов с НМРЛ.
Принимая во внимание, что способ, которым образуется растворимая форма ICAM-1, полностью не выяснен. Учитывая результат исследования in vitro , которое показало, что уровни sICAM-1 могут отражать экспрессию ICAM на культивируемых эндотелиальных клетках, Leeuwenberg JF (32) предположил, что sICAM-1 может представлять внеклеточную часть связанного с мембраной ICAM-1, которая выделяет от клеточной мембраны путем протеолитического расщепления. Однако другие исследования уже идентифицировали специфические транскрипты мРНК sICAM-1 в нормальных клетках бронхиального эпителия человека (33).Таким образом, sICAM-1 также можно рассматривать как секретируемый вариант сплайсинга ICAM-1, лишенный внутриклеточных и внутримембранных доменов. Следовательно, в генерации sICAM-1 задействованы по крайней мере два механизма.
В этом обзоре мы обнаружили, что концентрация sICAM-1 у пациентов с раком легких была значительно выше по сравнению с контрольной группой. Исследования Osaki T (18) и Kamiyoshihara M (19) показали, что циркулирующая концентрация sICAM-1 у пациентов с раком легкого достоверно коррелировала со стадией T.Кроме того, Grothey A (17) сообщил, что существует значительная корреляция между уровнями sICAM-1 и гистологической экспрессией ICAM-1 в опухоли. Все вышесказанное свидетельствует о том, что первичные опухолевые клетки являются одним из источников циркулирующего sICAM-1. Кроме того, Sprenger A (29) обнаружил, что уровни sICAM-1 у пациентов с метастазами были выше, чем у пациентов без метастазов. Поэтому они предположили, что sICAM-1 также может высвобождаться окружающими тканями или метастазами в орган. Высвобождение sICAM-1 может быть вызвано различными цитокинами и факторами роста.Клетки рака легких, по-видимому, способны продуцировать различные цитокины, а затем индуцировать экспрессию и секрецию ICAM-1. Это может быть одной из причин значительного повышения уровня sICAM-1 у пациентов с раком легких.
Однако клиническое и биологическое значение sICAM-1 при злокачественных новообразованиях до конца не изучено. Springer TA (34) сообщил, что связанный с мембраной ICAM-1 является костимулирующим фактором для клеточного иммунного ответа, опосредованного Т-клеточными рецепторами, и выделение ICAM-1 в опухолевых клетках может позволить им ускользнуть от анти-хозяина. иммунный ответ опухоли.С другой стороны, циркулирующий sICAM-1 может связываться с FAL-1 и, таким образом, конкурентно ингибировать адгезию лейкоцитов LFA-1 и ICAM-1 к опухолевым клеткам. Таким образом, sICAM-1 может блокировать взаимодействие между опухолевыми клетками и Т-лимфоцитами, позволяя опухолевым клеткам ускользать от иммунного надзора (31). Кроме того, поскольку повышенный уровень sICAM-1 может приводить к увеличению уровней цитокинов, Shin HS (26) предположил, что высокие уровни sICAM-1 могут вызывать повреждение тканей и, таким образом, способствовать миграции и инвазии опухоли.Кроме того, Gho et al. (11,12) сообщил, что sICAM-1, по-видимому, обладает способностью стимулировать ангиогенез и стимулировать рост опухолевых клеток. В то время как исследование Qian Q (15) продемонстрировало значительную корреляцию между исходными уровнями sICAM-1 и VEGF в сыворотке и косвенно подтвердило ангиогенную активность sICAM-1 у пациентов с НМРЛ. Следовательно, sICAM-1 играет важную роль в прогрессировании опухоли и метастазировании. Это также может объяснить значительную коррекцию между исходными уровнями sICAM-1 и стадиями заболевания.
Этот обзор показал, что три из шести исследований, в которых сообщалось о прогностическом влиянии исходных уровней sICAM-1 при НМРЛ, показали нам значительно обратную связь между уровнями sICAM-1 и выживаемостью (15,25,26). В то время как другие три отрицательных исследования, вероятно, были связаны с ограниченным числом пациентов (16-18). Хотя источник sICAM-1 полностью не выяснен, in vitro, исследований с использованием культивированных эндотелиальных клеток установили, что уровни sICAM-1 отражают экспрессию ICAM-1 в этих клетках (32).Следовательно, эндотелиальные клетки, по-видимому, являются важным источником sICAM-1. Более того, Dowlati A (25) предположил, что повышенные уровни sICAM-1 могут отражать высокую ангиогенную нагрузку опухолей и приводить к худшему прогнозу. Однако ни одно из 2 исследований, оценивающих прогностическое влияние sICAM-1 на SCLC, не обнаружило значимой корреляции между этими двумя переменными (26,28). Это может быть результатом небольшого размера выборки. Но это различие может также отражать биологию болезни.
Кроме того, оба исследования, оценивающие прогностическую ценность уровней sICAM-1, выявили значительную обратную связь между циркулирующими уровнями sICAM-1 и ответом на химиотерапию у пациентов с распространенным НМРЛ.Более того, в исследовании in vitro (35) было обнаружено, что резистентные к доксорубицину клетки имеют заметно более высокие уровни молекулы адгезии по сравнению с чувствительными. Все вышеизложенное указывает на то, что уровни циркулирующего sICAM-1 могут быть связаны с чувствительностью опухолевых клеток к химиотерапии. Требуются дополнительные проспективные исследования с большим количеством пациентов, чтобы прояснить природу этой проблемы.
В заключение, этот систематический обзор показывает, что, во-первых, уровни циркулирующего sICAM-1 у пациентов с раком легких заметно выше, чем у здоровых людей.Во-вторых, исходные уровни sICAM-1, очевидно, были связаны со статусом работоспособности, полом, типом гистологии и стадиями заболевания. Кроме того, уровни циркулирующего sICAM-1 у пациентов с НМРЛ, по-видимому, значительно снижаются из-за комбинированной химиотерапии, и, по-видимому, существует значительно обратная связь между уровнями sICAM-1, прогнозом и скоростью ответа у пациентов с немелкоклеточным раком легкого. Однако мы должны относиться к этим результатам с осторожностью, поскольку у этого обзора есть несколько ограничений.Существует значительная неоднородность когорт пациентов (многие из этих исследований включают различные стадии рака легких, а несколько исследований включают как SCLC, так и NSCLC) и стратегии лечения. Большинство включенных в окончательный вариант литературы представляют собой исследования с небольшой выборкой и без долгосрочного наблюдения. Кроме того, увеличение sICAM-1 было продемонстрировано при большом количестве доброкачественных и злокачественных опухолей, острых и хронических заболеваниях. Следовательно, необходимы дополнительные проспективные исследования с большим количеством пациентов для определения диагностической и прогностической ценности sICAM-1 у пациентов с раком легких.
Благодарности
Это исследование было поддержано грантом Китайского фонда естественных наук провинции Цзянсу (BK2008326), Медицинского фонда выдающихся ученых провинции Цзянсу (RC2007113).
Раскрытие информации: Авторы заявляют об отсутствии конфликта интересов.
Список литературы
- Molina JR, Yang P, Cassivi SD, et al.Немелкоклеточный рак легкого: эпидемиология, факторы риска, лечение и выживаемость. Mayo Clin Proc, 2008; 83: 584-94. [PubMed]
- Liotta LA, Stracke ML. Опухолевая инвазия и метастазы: биохимические механизмы. Cancer Treat Res 1988; 40: 223-38. [PubMed]
- Кояма С., Эбихара Т., Фукао К. Экспрессия молекулы межклеточной адгезии 1 (ICAM-1) во время развития инвазии и / или метастазирования карциномы желудка. J. Cancer Res Clin Oncol 1992; 118: 609-14. [PubMed]
- Johnson JP, Stade BG, Holzmann B и др.Экспрессия de novo молекулы межклеточной адгезии 1 в меланоме коррелирует с повышенным риском метастазирования. Proc Natl Acad Sci U S. A 1989; 86: 641-4. [PubMed]
- Witkowska AM, Borawska MH. Растворимая молекула межклеточной адгезии-1 (sICAM-1): обзор. Eur Cytokine Netw 2004; 15: 91-8. [PubMed]
- Webb DS. Мостовски = HS, Джеррард Т.Л. Цитокин-индуцированное усиление экспрессии ICAM-1 приводит к повышенной уязвимости опухолевых клеток к лизису, опосредованному моноцитами.J. Immunol 1991; 146: 3682-6. [PubMed]
- Braakman E, Goedegebuure PS, Vreugdenhil RJ, et al. Клетки ICAM-меланомы относительно устойчивы к CD3-опосредованному лизису Т-клеток. Int J Cancer 1990; 46: 475-80. [PubMed]
- Seth R, Raymond FD, Makgoba MW. Циркулирующие изоформы ICAM-1: перспективы диагностики воспалительных и иммунных нарушений. Ланцет 1991; 338: 83-4. [PubMed]
- Berendt AR, McDowall A, Craig AG и др. Сайт связывания на ICAM-1 для эритроцитов, инфицированных Plasmodium falciparum, перекрывается, но отличается от сайта связывания LFA-1.Cell 1992; 68: 71-81. [PubMed]
- Gearing AJ, Newman W. Циркулирующие молекулы адгезии при болезни. Immunol Today 1993; 14: 506-12. [PubMed]
- Gho YS, Kleinman HK, Sosne G. Ангиогенная активность растворимой молекулы межклеточной адгезии человека-1. Cancer Res 1999; 59: 5128-32. [PubMed]
- Gho YS, Kim PN, Li HC, et al. Стимуляция роста опухоли растворимой молекулой межклеточной адгезии человека-1. Cancer Res 2001; 61: 4253-7. [PubMed]
- Alexiou D, Karayiannakis AJ, Syrigos KN, et al.Уровни E-селектина, ICAM-1 и VCAM-1 в сыворотке крови у пациентов с колоректальным раком: корреляции с клинико-патологическими особенностями, выживаемостью пациентов и хирургическим вмешательством. Eur J Cancer 2001; 37: 2392-7. [PubMed]
- Наката Б., Хори Т., Сунами Т. и др. Клиническое значение растворимой в сыворотке молекулы межклеточной адгезии 1 при раке желудка. Clin Cancer Res 2000; 6: 1175-9. [PubMed]
- Qian Q, Zhan P, Yu L, et al. Исходные уровни и снижение уровня растворимой в сыворотке молекулы межклеточной адгезии-1 во время химиотерапии предсказывают объективный ответ и выживаемость у пациентов с распространенным немелкоклеточным раком легкого.Clin рака легких 2011; 12: 131-7. [PubMed]
- Guney N, Soydinc HO, Derin D, et al. Уровни в сыворотке крови молекулы межклеточной адгезии ICAM-1 и E-селектина при немелкоклеточном раке легкого на поздней стадии. Мед Онкол 2008; 25: 194-200. [PubMed]
- Гротей А., Хейстерманн П., Филиппу С. и др. Сывороточные уровни растворимой молекулы межклеточной адгезии-1 (ICAM-1, CD54) у пациентов с немелкоклеточным раком легкого: корреляция с гистологической экспрессией ICAM-1 и стадией опухоли.Br J Cancer 1998; 77: 801-7. [PubMed]
- Осаки Т., Мицудоми Т., Йошида Ю. и др. Повышенные уровни сывороточной молекулы межклеточной адгезии-1 (ICAM-1) у пациентов с немелкоклеточным раком легкого. Surg Oncol 1996; 5: 107-13. [PubMed]
- Kamiyoshihara M, Kawashima O, Otani Y, et al. Клиническое значение предоперационной растворимой в сыворотке молекулы межклеточной адгезии-1 при немелкоклеточном раке легкого. J. Cardiovasc Surg (Турин) 2002; 43: 729-34. [PubMed]
- Стааль-ван ден Брекель А.Дж., Дентенер М.А., Схолс А.М. и др.Повышенный расход энергии в покое и потеря веса связаны с системной воспалительной реакцией у пациентов с раком легких. Дж. Клин Онкол 1995; 13: 2600-5. [PubMed]
- De Vita F, Infusino S, Auriemma A, Orditura M, Catalano G. Циркулирующие уровни растворимой молекулы межклеточной адгезии-1 у пациентов с немелкоклеточным раком легкого. Онкол Реп 1998; 5: 393-6. [PubMed]
- Юрдакуль А.С., Хан Э.Р., Букан Н., Озтюрк С. Роль молекул адгезии сыворотки и фактора роста эндотелия сосудов у пациентов с раком легких.Turkiye Klinikleri Tip Bilimleri Dergisi 2010; 30: 1214-19.
- Taguchi O, Gabazza EC, Kobayashi T, et al. Циркулирующая молекула межклеточной адгезии-1 у больных раком легкого. Intern Med 1997; 36: 14-8. [PubMed]
- Гогали А., Харалабопулос К., Зампира И. и др. Растворимые молекулы адгезии E-кадгерин, молекула межклеточной адгезии-1 и E-селектин в качестве биомаркеров рака легких. Сундук 2010; 138: 1173-9. [PubMed]
- Доулати А., Грей Р., Сандлер А.Б. и др.Молекулы клеточной адгезии, фактор роста эндотелия сосудов и основной фактор роста фибробластов у пациентов с немелкоклеточным раком легкого, получавших химиотерапию с бевацизумабом или без него — исследование Восточной совместной онкологической группы. Clin Cancer Res 2008; 14: 1407-12. [PubMed]
- Шин Х.С., Юнг Ч.Х., Парк HD и др. Взаимосвязь между уровнем молекулы-1 межклеточной адгезии в сыворотке крови и прогнозом заболевания при раке легкого. Корейский журнал J Intern Med 2004; 19: 48-52. [PubMed]
- Стааль-ван ден Брекель AJ, Schols AM, Dentener MA, et al.Влияние химиотерапии на энергетический обмен и медиаторы воспаления при мелкоклеточной карциноме легкого. Br J Cancer 1997; 76: 1630-5. [PubMed]
- Хорн Л., Дальберг С.Е., Сандлер А.Б. и др. Исследование фазы II цисплатина, этопозида и бевацизумаба для лечения ранее нелеченного, обширного мелкоклеточного рака легкого: исследование E3501 Восточной совместной онкологической группы. Дж. Клин Онкол 2009; 27: 6006-11. [PubMed]
- Sprenger A, Schardt C, Rotsch M, et al. Растворимая молекула межклеточной адгезии-1 у пациентов с раком легкого и доброкачественными заболеваниями легких.J. Cancer Res Clin Oncol 1997; 123: 632-8. [PubMed]
- Ханрахан Э.О., Лин Х.Й., Ким Э.С. и др. Определенные закономерности модуляции цитокинов и ангиогенного фактора и маркеры пользы для вандетаниба и / или химиотерапии у пациентов с немелкоклеточным раком легкого. Дж. Клин Онкол 2010; 28: 193-201. [PubMed]
- van de Stolpe A, van der Saag PT. Молекула межклеточной адгезии-1. Ж. Мол Мед (Берл) 1996; 74: 13-33. [PubMed]
- Леувенберг Дж. Ф., Смитс Э. Ф., Нифджес Дж. Дж. И др.Е-селектин и молекула межклеточной адгезии-1 высвобождаются активированными эндотелиальными клетками человека in vitro. Иммунология 1992; 77: 543-9. [PubMed]
- Whiteman SC, Bianco A, Knight RA, et al. Риновирус человека избирательно модулирует мембранные и растворимые формы своего рецептора молекулы-1 межклеточной адгезии (ICAM-1), способствуя инфекционности эпителиальных клеток. J Biol Chem 2003; 278: 11954-61. [PubMed]
- Springer TA. Рецепторы адгезии иммунной системы. Nature 1990; 346: 425-34.[PubMed]
- Rivoltini L, Cattoretti G, Arienti F, et al. Высокая лизируемость клетками LAK клеток карциномы толстой кишки, устойчивых к доксорубицину, связана с высокой экспрессией ICAM-1, LFA-3, NCA и менее дифференцированным фенотипом. Int J Cancer 1991; 47: 746-54. [PubMed]
Цитируйте эту статью как: Гу X, Ма С., Юань Д., Сонг Й. Циркулирующая растворимая молекула межклеточной адгезии-1 при раке легких: систематический обзор. Перевод Lung Cancer Res 2012; 1: 36-44.DOI: 10.3978 / j.issn.2218-6751.08.01
Какие микроскопические находки характерны для плоскоклеточного рака (ПКР)?
Fischer-Valuck BW, Michalski JM, Contreras JA, et al. Анализ предрасположенности, сравнивающий окончательную химиолучевую терапию при мышечно-инвазивной плоскоклеточной карциноме мочевого пузыря и уротелиальной карциноме мочевого пузыря с использованием Национальной базы данных по раку. Clin Transl Radiat Oncol . 2019 Февраль 15: 38-41. [Медлайн]. [Полный текст].
Американское общество клинической онкологии (ASCO). Рак мочевого пузыря: введение. Cancer.Net. Доступно по адресу https://www.cancer.net/cancer-types/bladder-cancer/introduction. Октябрь 2017 г .; Доступ: 24 января 2019 г.
Martin JW, Carballido EM, Ahmed A, et al. Плоскоклеточный рак мочевого пузыря: систематический обзор клинических характеристик и терапевтических подходов. Араб Дж Урол . 2016 Сентябрь 14 (3): 183-91. [Медлайн].[Полный текст].
Американское онкологическое общество. Что такое рак мочевого пузыря ?. Доступно по адресу https://www.cancer.org/cancer/bladder-cancer/about/what-is-bladder-cancer.html. 26 января 2016 г .; Доступ: 24 января 2019 г.
Wong MCS, Fung FDH, Leung C, Cheung WWL, Goggins WB, Ng CF. Глобальная эпидемиология рака мочевого пузыря: регрессионный анализ тенденций и прогнозов заболеваемости и смертности. Sci Rep . 2018 18 января. 8 (1): 1129.[Медлайн].
Американская урологическая ассоциация. Плоскоклеточная карцинома. Доступно по адресу https://www.auanet.org/education/auauniversity/education-products-and-resources/pathology-for-urologists/urinary-bladder/non-urothelial-carcinomas/squamous-cell-carcinoma. Доступ: 24 января 2019 г.
Jorgensen KR, Hoyer S, Jakobsen JK, et al. Вирус папилломы человека и плоскоклеточный рак мочевого пузыря: исследование DaBlaCa-10. Scand J Urol .2018 г. 11. 1-6. [Медлайн].
Чепмен-Фредрикс Дж. Р., Чиоффи-Лавина М., Аккола М. А. и др. ДНК вируса папилломы человека высокого риска обнаружена при первичной плоскоклеточной карциноме мочевого пузыря. Arch Pathol Lab Med . 2013 Август 137 (8): 1088-93. [Медлайн].
Блохин Е.Б., Парк К.Дж., Тикоо С.К., Рейтер В.Е., Аль-Ахмади Х. Уротелиальная карцинома с выраженной плоскоклеточной дифференцировкой в условиях нейрогенного мочевого пузыря: роль инфекции вируса папилломы человека. Мод Патол . 2012 25 ноября (11): 1534-42. [Медлайн].
Джинори А., Бароне А., Сантопьетро Р., Барбанти Г., Чеккони Ф, Триподи С.А. Базалоидная плоскоклеточная карцинома мочевого пузыря, связанная с вирусом папилломы человека, ассоциированная с инфекцией вируса папилломы человека половых путей. Int J Urol . 2015 22 февраля (2): 222-5. [Медлайн].
Шигехара К., Намики М. Редакционный комментарий к базалоидной плоскоклеточной карциноме мочевого пузыря, связанной с вирусом папилломы человека, ассоциированной с инфекцией вируса папилломы человека половых путей. Int J Urol . 2015 22 февраля (2): 225-6. [Медлайн].
Izard JP, Siemens DR, Mackillop WJ, et al. Результаты плоской гистологии при раке мочевого пузыря: популяционное исследование. Урол Онкол . 2015 Октябрь, 33 (10): 425.e7-13. [Медлайн].
Action Bladder Cancer UK. Виды рака мочевого пузыря. Доступно по адресу http://actionbladdercanceruk.org/types-of-bladder-cancer/. Доступ: 24 января 2019 г.
Саккас JL.Клиника и лечение плоскоклеточного рака мочевого пузыря. Int Surg . 1966, январь, 45 (1): 71-6. [Медлайн].
Johnson DE, Schoenwald MB, Ayala AG, Miller LS. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1976 Май. 115 (5): 542-4. [Медлайн].
Сарма КП. Плоскоклеточный рак мочевого пузыря. Int Surg . 1970 Май. 53 (5): 313-9. [Медлайн].
Bessette PL, Abell MR, Herwig KR.Клинико-патологическое исследование плоскоклеточного рака мочевого пузыря. Дж Урол . 1974 июл.112 (1): 66-7. [Медлайн].
Ньюман Д.М., Браун-младший, Джей А.С., Понтиус Э. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1968 Октябрь 100 (4): 470-3. [Медлайн].
Mazaris E, Nafie S, Boustead G. Способна ли ТУР мочевого пузыря вылечить рецидивирующий поверхностный или мышечно-инвазивный рак мочевого пузыря с высоким риском: факторы, приводящие к образцам радикальной цистэктомии pT0. Инт Браз Дж Урол . 2013 май-июнь. 39 (3): 364-70. [Медлайн].
Невес TR, Соарес MJ, Монтейро PG, Лима MS, Монтейро HG. Базалоидная плоскоклеточная карцинома мочевого пузыря с мелкоклеточной карциномой. J Clin Oncol . 2011 20 мая. 29 (15): e440-2. [Медлайн].
Holck S, Jorgensen L. Веррукозная карцинома мочевого пузыря. Урология . 1983 22 октября (4): 435-7. [Медлайн].
Blackmore CC, Ratcliffe NR, Harris RD.Веррукозный рак мочевого пузыря. Abdom Imaging . 1995 сентябрь-октябрь. 20 (5): 480-2. [Медлайн].
Boileau M, Hui KK, Cowan DF. Облучение инвазивной бородавчатой карциномы мочевого пузыря. Урология . 1986, 27 января (1): 56-9. [Медлайн].
Вальтер М., О’Брайен Д. П. 3-й, Берч HW. Острые кондиломы и бородавчатая карцинома мочевого пузыря: клинический случай и обзор литературы. Дж Урол . 1986 Февраль 135 (2): 362-5.[Медлайн].
Вакар-Лопес Ф., Абрамс Дж. Базалоидная плоскоклеточная карцинома мочевого пузыря. Arch Pathol Lab Med . 2000 марта, 124 (3): 455-9. [Медлайн].
Bostwick GD, Cheng L. Новообразования мочевого пузыря. Боствик Г.Д., Ченг Л., ред. Урологическая хирургическая патология: консультация специалиста . 2-е изд. Филадельфия, Пенсильвания: Эльзевьер / Мосби; 2008. 309.
Wu RL, Osman I, Wu XR, et al.Ген уроплакина II экспрессируется в переходно-клеточной карциноме, но не в плоскоклеточной карциноме бильгарциального пузыря: альтернативные пути дифференцировки эпителия мочевого пузыря и образования опухоли. Cancer Res . 1998 15 марта. 58 (6): 1291-7. [Медлайн]. [Полный текст].
Джи Дж. Р., Монтойя Р. Г., Халед Х. М., Сабичи А. Л., Гроссман Н. Б.. Экспрессия цитокератина 20, AN43, PGDH и COX-2 при переходной и плоскоклеточной карциноме мочевого пузыря. Урол Онкол .2003 июл-авг. 21 (4): 266-70. [Медлайн].
Али М.С., Халед Х.М. Хромосомные аберрации при ранней стадии бильгарциального рака мочевого пузыря. Cancer Genet Cytogenet . 2002 г., 1. 132 (1): 41-5. [Медлайн].
Эль-Рифаи В., Камель Д., Ларраменди М.Л. и др. Изменения количества копий ДНК при раке мочевого пузыря, ассоциированном и не ассоциированном с шистосомой. Ам Дж. Патол . 2000 Март 156 (3): 871-8. [Медлайн]. [Полный текст].
Fadl-Elmula I, Kytola S, Leithy ME, et al.Хромосомные аберрации при доброкачественных и злокачественных поражениях мочевого пузыря, связанных с бильгарзией, проанализированы с помощью сравнительной геномной гибридизации. BMC Cancer . 2002 22 марта, 2: 5. [Медлайн]. [Полный текст].
Gonzalez-Zulueta M, Shibata A, Ohneseit PF, et al. Высокая частота аллельной потери хромосомы 9p и изменений гена-супрессора опухоли CDKN2 при плоскоклеточном раке мочевого пузыря. J Natl Cancer Inst . 1995 20 сентября. 87 (18): 1383-93. [Медлайн].
Muscheck M, Abol-Enein H, Chew K и др.Сравнение генетических изменений переходного и плоскоклеточного рака мочевого пузыря, связанных с шистосомами, с использованием сравнительной геномной гибридизации. Канцерогенез . 2000 Сентябрь 21 (9): 1721-6. [Медлайн].
Pycha A, Mian C, Posch B и др. Численные хромосомные аберрации при мышечно-инвазивном плоскоклеточном раке и переходно-клеточном раке мочевого пузыря: альтернатива классическим прогностическим показателям ?. Урология . 1999 Май. 53 (5): 1005-10. [Медлайн].
Шоу М.Э., старейшина П.А., Аббас А., Ноулз Массачусетс. Частичный аллелотип рака мочевого пузыря, ассоциированного с шистосомозом. Инт Дж. Рак . 1 марта 1999 г. 80 (5): 656-61. [Медлайн]. [Полный текст].
Habuchi T., Takahashi R, Yamada H, et al. Влияние курения сигарет и шистосомоза на мутацию гена p53 при уротелиальном раке. Cancer Res . 1993 15 августа. 53 (16): 3795-9. [Медлайн]. [Полный текст].
Ramchurren N, Cooper K, Summerhayes IC.Молекулярные явления, лежащие в основе рака мочевого пузыря, связанного с шистосомозом. Инт Дж. Рак . 1995 28 июля, 62 (3): 237-44. [Медлайн].
Warren W, Biggs PJ, el-Baz M, Ghoneim MA, Stratton MR, Venitt S. Мутации в гене p53 при шистосомном раке мочевого пузыря: исследование 92 опухолей у египетских пациентов и сравнение мутационных спектров шистосомных и других опухолей. -шистосомальные уротелиальные опухоли. Канцерогенез . 1995 Май. 16 (5): 1181-9. [Медлайн].
Абдуламир А.С., Хафид Р.Р., Кадхим Х.С., Абубакар Ф. Онкологические маркеры рака мочевого пузыря: шистосомные опухоли мочевого пузыря по сравнению с нешистосомными опухолями мочевого пузыря. J Exp Clin Cancer Res . 2009 25 февраля, 28:27. [Медлайн]. [Полный текст].
Przybojewska B, Jagiello A, Jalmuzna P. Активация генов H-RAS, K-RAS и N-RAS при раке мочевого пузыря человека. Cancer Genet Cytogenet . 2000 августа 121 (1): 73-7. [Медлайн].
Rabbani F, Cordon-Cardo C.Мутации регуляторов клеточного цикла и их влияние на поверхностный рак мочевого пузыря. Urol Clin North Am . 2000, 27 февраля (1): 83-102, ix. [Медлайн].
Guo CC, Gomez E, Tamboli P, et al. Плоскоклеточный рак мочевого пузыря: клинико-патологическое и иммуногистохимическое исследование 16 случаев. Хум Патол . 2009 Октябрь 40 (10): 1448-52. [Медлайн].
Badawi AF, Cooper DP, Mostafa MH, et al. Активность O6-алкилгуанин-ДНК-алкилтрансферазы при раке мочевого пузыря человека, ассоциированном с шистосомозом. Eur J Cancer . 1994. 30A (9): 1314-9. [Медлайн].
Badawi AF, Mostafa MH, Aboul-Azm T, Haboubi NY, O’Connor PJ, Cooper DP. Повреждение промутагенным метилированием в ДНК мочевого пузыря у пациентов с раком мочевого пузыря, ассоциированным с шистосомозом, и у здоровых людей. Канцерогенез . 1992 Май. 13 (5): 877-81. [Медлайн].
Фадл-Эльмула I, Горунова Л., Лундгрен Р. и др. Хромосомные аномалии в двух карциномах мочевого пузыря с вторичной дифференцировкой плоскоклеточных клеток. Cancer Genet Cytogenet . 1998 15 апреля. 102 (2): 125-30. [Медлайн].
Lundgren R, Elfving P, Heim S, Kristoffersson U, Mandahl N, Mitelman F. Плоскоклеточная карцинома мочевого пузыря с кариотипическими аномалиями, напоминающими переходно-клеточную карциному. Дж Урол . 1989, август 142 (2, п.1): 374-6. [Медлайн].
Ванни Р., Скарпа Р.М., Ниедду М., Усай Э. Цитогенетическое исследование 30 карцином мочевого пузыря. Cancer Genet Cytogenet .1988 30 января (1): 35-42. [Медлайн].
Faysal MH. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1981 ноябрь 126 (5): 598-9. [Медлайн].
Ричи Дж. П., Вайсман Дж., Скиннер Д. Г., Дретлер СП. Плоский рак мочевого пузыря: лечение радикальной цистэктомией. Дж Урол . 1976 июн. 115 (6): 670-2. [Медлайн].
Winkler HZ, Nativ O, Hosaka Y, Farrow GM, Lieber MM. Плоидность ядерной дезоксирибонуклеиновой кислоты при плоскоклеточном раке мочевого пузыря. Дж Урол . 1989, февраль, 141 (2): 297-302. [Медлайн].
Shaaban AA, Javadpour N, Tribukait B, Ghoneim MA. Прогностическое значение анализа проточной ДНК и изоантигенов клеточной поверхности при карциноме бильгарциального пузыря. Урология . 1992 марта 39 (3): 207-10. [Медлайн].
Udager AM, McDaniel AS, Hovelson DH, et al. Частая экспрессия белка PD-L1 и молекулярная корреляция при плоскоклеточном раке мочевого пузыря. Eur Urol .2018 Октябрь 74 (4): 529-31. [Медлайн].
Абдель-Рахман О. Плоскоклеточный рак мочевого пузыря: анализ базы данных SEER. Clin Genitourin Cancer . 2017 июн.15 (3): e463-8. [Медлайн].
Zhang X, Zhang M, Hou Y, et al. Одноклеточный анализ транскрипционной гетерогенности плоскоклеточного рака мочевого пузыря. Онкотоваргет . 2016 4 октября. 7 (40): 66069-76. [Медлайн]. [Полный текст].
Rausch S, Lotan Y, Youssef RF.Плоскоклеточный канцерогенез и плоскоклеточный рак мочевого пузыря: современный обзор с акцентом на небилгарциальный плоскоклеточный рак. Урол Онкол . 2014 января, 32 (1): 32.e11-6. [Медлайн].
% PDF-1.7 % 99 0 объект > эндобдж xref 99 99 0000000016 00000 н. 0000003070 00000 н. 0000003257 00000 н. 0000003292 00000 н. 0000003920 00000 н. 0000004052 00000 н. 0000004089 00000 н. 0000004116 00000 п. 0000004228 00000 п. 0000004917 00000 н. 0000005319 00000 п. 0000005988 00000 н. 0000006102 00000 п. 0000006620 00000 н. 0000006735 00000 н. 0000007695 00000 н. 0000007831 00000 н. 0000008705 00000 н. 0000008837 00000 н. 0000009088 00000 н. 0000009271 00000 н. 0000009676 00000 н. 0000010098 00000 п. 0000010125 00000 п. 0000010737 00000 п. 0000011671 00000 п. 0000012440 00000 п. 0000013187 00000 п. 0000013319 00000 п. 0000013753 00000 п. 0000014372 00000 п. 0000015009 00000 п. 0000015036 00000 п. 0000015294 00000 п. 0000015766 00000 п. 0000016020 00000 н. 0000016638 00000 п. 0000017610 00000 п. 0000018609 00000 п. 0000019166 00000 п. 0000021816 00000 п. 0000021886 00000 п. 0000021985 00000 п. 0000051879 00000 п. 0000052263 00000 п. 0000052376 00000 п. 0000074767 00000 п. 0000116932 00000 н. 0000117002 00000 н. 0000117072 00000 н. 0000117212 00000 н. 0000149936 00000 н. 0000150201 00000 н. 0000150464 00000 н. 0000187084 00000 н. 0000187352 00000 н. 0000217786 00000 н. 0000218271 00000 н. 0000218871 00000 н. 0000218984 00000 н. 0000219054 00000 н. 0000219155 00000 н. 0000234396 00000 н. 0000234677 00000 н. 0000235109 00000 п. 0000235136 00000 п. 0000235670 00000 н. 0000236131 00000 п. 0000236409 00000 н.

 Химиотерапия
Химиотерапия